இருகுளோரின் ஏழாக்சைடு
இருகுளோரின் ஏழாக்சைடு (dichlorine heptoxide, டைகுளோரின் எப்டாக்சைடு) என்பது Cl2O7 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். இது பெர்குளோரிக் அமிலத்தின் நீரிலியாகும். பாசுபரசு ஐந்தாக்சைடு முன்னிலையில் பெர்குளோரிக் அமிலத்தை கவனமாகக் காய்ச்சி வடித்து இருகுளோரின் ஏழாக்சைடைத் தயாரிக்கலாம்.:[1]
- 2 HClO4 + P4O10 → Cl2O7 + H2P4O11
 | |
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
டைகுளோரின் எப்டாக்சைடு | |
| வேறு பெயர்கள்
குளோரின்(VII) ஆக்சைடு; பெர்குளோரிக் நீரிலி; (பெர்குளோரைலாக்சி)குளோரேன் மூவாக்சைடு | |
| இனங்காட்டிகள் | |
| 10294-48-1 | |
| ChEBI | CHEBI:52356 |
| ChemSpider | 109884 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 123272 |
SMILES
| |
| பண்புகள் | |
| Cl2O7 | |
| வாய்ப்பாட்டு எடை | 182.901 கி/மோல் |
| தோற்றம் | நிறமற்ற எண்ணெய் |
| அடர்த்தி | 1900 kg m−3 |
| உருகுநிலை | |
| கொதிநிலை | 82 °C (180 °F; 355 K) |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | ஆக்சிசனேற்றி, தொடுகையில் வெடிக்கும் [1] |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
இறுதி விளை பொருள் கலவையில் இருந்து இச்சேர்மத்தை வடித்துப் பிரிக்கலாம்.
குளோரின் மற்றும் ஓசோன்[2] கலந்த கலவையை ஒளியூட்டுவதாலும் இருகுளோரின் ஏழாக்சைடு தயாரிக்க முடியும். பின்னர் இது மெல்ல நீராற்பகுப்பு அடைந்து பெர்குளோரிக் அமிலமாக மீள்கிறது. நீரிலியாக இருக்கும் போது பெர்குளோரிக் அமிலமும் ஒரு நச்சாகவே இருக்கிறது.
அமைப்பு
இருகுளோரின் ஏழாக்சைடு ஒரு வெப்பங்கொள் மூலக்கூறாகும். அதாவது உள்ளார்ந்த முறையில் இது நிலைப்புத் தன்மை அற்றதாகக் காணப்படுகிறது.
- 2 Cl2O7 → 2 Cl2 + 7 O2 (ΔH = −135 kJ/mol)
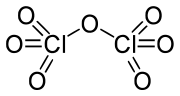
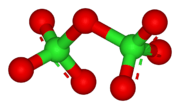
Cl2O7 வளைந்த Cl-O-Cl மூலக்கூறு அமைப்புடன் பிணைப்புக் கோணம் 118.6° அளவைக் கொண்டு C2 சீரொழுங்குள்ள மூலக்கூறு அமைப்புடன் காணப்படுகிறது. விளிம்பு நிலை Cl-O பிணைப்புகளின் நீளம் 1.709 Å ஆகவும் மற்றும் Cl=O பிணைப்பின் பிணைப்பு நீளம் 1.405 Å [1] ஆகவும் உள்ளது. இச்சேர்மத்தில் சகப்பிணைப்பு இருந்தபோதிலும் குளோரின் அதனுடைய அதிகபட்ச ஆக்சிசனேற்ற நிலை எண் +7 இல் காணப்படுகிறது.
வேதியியல்
கார்பன் நாற்குளோரைடு கரைசலில் உள்ள முதல்நிலை மற்றும் இரண்டாம்நிலை அமீன்களுடன் இருகுளோரின் ஏழாக்சைடு வினைபுரிந்து N- பெர்குளோரைல்களைக் கொடுக்கிறது.:[3]
- 2 RNH
2 + Cl
2O
7 → 2 RNHClO
3 + H
2O - 2 R
2NH + Cl
2O
7 → 2 R
2NClO
3 + H
2O
ஆல்க்கீன்களுடனும் வினைபுரிந்து ஆல்க்கைல் பெர்குளோரேட்டுகளைத் தருகிறது. உதாரணமாக இது கார்பன் நாற்குளோரைடில் உள்ள புரோப்பீனுடன் வினைபுரிந்து ஐசோபுரோபைல் பெர்குளோரேட்டு மற்றும் 1-குளோரோ-2-புரோபைல் பெர்குளோரேட்டுகளைத் தருகிறது.[4]
இருகுளோரின் ஏழாக்சைடு ஓரு வலிமையான அமில ஆக்சைடாகும். கரைசலில் இது பெர்குளோரிக் அமிலத்துடன் சமநிலை கொண்டுள்ள சேர்மமாக உருவாகிறது.
பாதுகாப்பு
அதிக நிலைப்புத் தன்மை கொண்ட சேர்மமாக இருந்தபோதிலும் இருகுளோரின் ஏழாக்சைடு ஒரு வலிமையான ஆக்சிசனேற்றியாகவும் தீச்சுவாலை அல்லது சிறு அதிர்வு அல்லது அயோடினுடன் தொடர்பு ஆகியவற்றால் வெடிக்கும் தன்மையைப் பெறுகிறது. பிற குளோரின் ஆக்சைடுகளைவிட குறைவாகவே ஆக்சிசனேற்றம் அடைவதால், இது கந்தகம், பாசுபரசு அல்லது காகிதம் ஆகியவை ஈரமாக இருக்கும் போது அவற்றைப் பாதிப்பதில்லை. குளோரின்[5] மனிதனுக்கு உண்டாக்கும் தீங்குகள் அனைத்தையும் இதுவும் உண்டாக்குகிறது. எனவே குளோரினுக்கு எடுக்க வேண்டிய பாதுகாப்பு நடவடிக்கைகள் அனைத்தும் இதற்கும் அவசியாமாகும்.[6]
மேற்கோள்கள்
- Holleman, Arnold F.; Wiberg, Egon (2001). Inorganic chemistry. Translated by Mary Eagleson, William Brewer. San Diego: Academic Press. பக். 464. பன்னாட்டுத் தரப்புத்தக எண்:0-12-352651-5.
- Byrns, A. C.; Rollefson, G. K. (1934). "The Formation of Chlorine Heptoxide on Illumination of Mixtures of Chlorine and Ozone". Journal of the American Chemical Society 56 (5): 1250–1251. doi:10.1021/ja01320a506.
- Beard, C. D.; Baum, K. (1974). "Reactions of dichlorine heptoxide with amines". Journal of the American Chemical Society 96 (10): 3237–3239. doi:10.1021/ja00817a034.
- Baum, K. . (1976). "Reactions of dichlorine heptoxide with olefins". The Journal of Organic Chemistry 41 (9): 1663–1665. doi:10.1021/jo00871a048.
- Lewis, Robert Alan (1998). Lewis' dictionary of toxicology. CRC Press. பக். 260. பன்னாட்டுத் தரப்புத்தக எண்:1-56670-223-2.
- "Halogens and their compounds". Encyclopaedia of occupational health and safety (4th). (1998). Ed. Jeanne Mager Stellman. International Labour Organization. ISBN 92-2-109817-6.
| குளோரைடுகள் | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HCl | He | ||||||||||||||||||
| LiCl | BeCl2 | BCl3 B2Cl4 |
CCl4 | NCl3 ClN3 |
Cl2O ClO2 Cl2O7 |
ClF ClF3 ClF5 |
Ne | ||||||||||||
| NaCl | MgCl2 | AlCl AlCl3 |
SiCl4 | P2Cl4 PCl3 PCl5 |
S2Cl2 SCl2 SCl4 |
Cl2 | Ar | ||||||||||||
| KCl | CaCl CaCl2 |
ScCl3 | TiCl2 TiCl3 TiCl4 |
VCl2 VCl3 VCl4 VCl5 |
CrCl2 CrCl3 CrCl4 |
MnCl2 | FeCl2 FeCl3 |
CoCl2 CoCl3 |
NiCl2 | CuCl CuCl2 |
ZnCl2 | GaCl2 GaCl3 |
GeCl2 GeCl4 |
AsCl3 AsCl5 |
Se2Cl2 SeCl4 |
BrCl | KrCl | ||
| RbCl | SrCl2 | YCl3 | ZrCl3 ZrCl4 |
NbCl4 NbCl5 |
MoCl2 MoCl3 MoCl4 MoCl5 MoCl6 |
TcCl4 | RuCl3 | RhCl3 | PdCl2 | AgCl | CdCl2 | InCl InCl2 InCl3 |
SnCl2 SnCl4 |
SbCl3 SbCl5 |
Te3Cl2 TeCl4 |
ICl ICl3 |
XeCl XeCl2 | ||
| CsCl | BaCl2 | HfCl4 | TaCl5 | WCl2 WCl3 WCl4 WCl5 WCl6 |
Re3Cl9 ReCl4 ReCl5 ReCl6 |
OsCl4 | IrCl2 IrCl3 IrCl4 |
PtCl2 PtCl4 |
AuCl AuCl3 |
Hg2Cl2, HgCl2 |
TlCl | PbCl2, PbCl4 |
BiCl3 | PoCl2, PoCl4 |
AtCl | RnCl2 | |||
| FrCl | RaCl2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| LaCl3 | CeCl3 | PrCl3 | NdCl2, NdCl3 |
PmCl3 | SmCl2, SmCl3 |
EuCl2, EuCl3 |
GdCl3 | TbCl3 | DyCl2, DyCl3 |
HoCl3 | ErCl3 | TmCl2 TmCl3 |
YbCl2 YbCl3 |
LuCl3 | |||||
| AcCl3 | ThCl4 | PaCl5 | UCl3 UCl4 UCl5 UCl6 |
NpCl4 | PuCl3 | AmCl2 AmCl3 |
CmCl3 | BkCl3 | CfCl3 | EsCl3 | Fm | Md | No | LrCl3 | |||||