குளோரசமிலம்
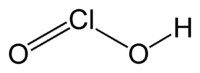
குளோரசமிலம் (Chlorous acid) என்பது HClO2 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். வீரியம் குறைந்த இவ்வமிலத்தில் குளோரின் +3 என்ற ஆக்சிசனேற்ற நிலையில் உள்ளது. தூய்மையான நிலையில் குளோரசமிலம் நிலைப்புத்தன்மையற்று ஐப்போ குளோரசமிலமாகவும் குளோரிக் அமிலமாகவும் விகிதச் சமமாதலின்றி பிரிகையடைகிறது. ஐப்போ குளோரசமிலத்தில் குளோரின் +1 என்ற ஆக்சிசனேற்ற நிலையிலும் குளோரிக் அமிலத்தில் +5 என்ற ஆக்சிசனேற்ற நிலையிலும் காணப்படுகிறது.
- 2 HClO2 → HClO + HClO3
 | |
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
குளோரசமிலம் | |
| இனங்காட்டிகள் | |
| 13898-47-0 | |
| ChEBI | CHEBI:29219 |
| ChemSpider | 22861 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| KEGG | C01486 |
| பப்கெம் | 24453 |
SMILES
| |
| பண்புகள் | |
| HClO2 | |
| வாய்ப்பாட்டு எடை | 68.46 கி/மோல் |
| காடித்தன்மை எண் (pKa) | 1.96 |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
இவ்வமிலத்தை தூய்மையான நிலையில் பெறுவது கடினம் என்றபோதிலும் குளோரசமிலத்திலிருந்து தயாரிக்கப்படும் இதனுடைய இணை காரமான குளோரைட் நிலைப்புத்தன்மையுடன் காணப்படுகிறது. இந்த எதிர்மின் அயனியால் உருவாகும் உப்புக்கு எடுத்துக்காட்டாக சோடியம் குளோரைட்டை கூறலாம். சோடியம் குளோரைட் மற்றும் இதனோடு தொடர்புடைய உப்புகள் சில சமயங்களில் குளோரின் ஈராக்சைடு தயாரிக்கப் பயன்படுகின்றன.
தயாரிப்பு
பேரியம் குளோரைட்டுடன் நீர்த்த கந்தக அமிலத்தைச் சேர்த்து சூடாக்குவதன் மூலமாக குளோரசமிலத்தை தயாரிக்கமுடியும்.
- Ba(ClO2)2 + H2SO4 → BaSO4 + 2HClO2
நிலைப்புத்தன்மை
விகிதச்சமமாதலின்மை குளோரசமிலத்தின் ஆக்சிசனேற்றும் திறனை மட்டுப்படுத்தினாலும் கூட இது வொரு வலிமையான ஆக்சிசனேற்றியாகச் செயல்படுகிறது.
ஆலசன்களில் குளோரின் மட்டுமே தனித்துப் பிரித்தெடுக்கும் HXO2 வகையிலான அமிலங்களைத் தருகிறது. புரோமசமிலத்தையோ அயோடசமிலத்தையோ எப்போதுமே தனித்துப் பிரித்தெடுக்க முடிவதில்லை. புரோஅசமிலத்தின் புரோமைட் உப்புகள் சிலவாவது அறியப்படுகின்றன. ஆனால் அயோடைட் என்ற உப்புகள் எதுவும் அறியக் கிடைக்கவில்லை[1] Neither bromous acid nor iodous acid has ever been isolated. A few salts of bromous acid, bromites, are known, but no iodites.[1].
மேற்கோள்கள்

- Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5