உபகுளோரசு அமிலம்
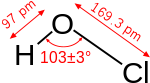
உபகுளோரசு அமிலம் (Hypochlorous acid) ஓர் உறுதியற்ற அமிலமாகும். இதன் வேதியியல் குறியீடு HOCl. குளோரின் நீரில் கரையும் போது இவ்வமிலம் தோன்றுகின்றது. இது உடனடியான மீழும் சேர்வையாக இருப்பதனால் இதனை தூய நிலையில் காணமுடியாது. உபகுளோரசு அமிலம் ஒரு ஒடுக்க-ஏற்ற வேதிவினைகள் கொண்டதாகவும் அதன் சோடியம் உப்பு (NaClO),அல்லது கல்சியம் உப்பு(Ca(CIO)2) தொற்று நீக்கியாகவும், வெளிற்றுமியல்பு கொண்டவையாகவும் பயன்படும்.
 | |
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
ஐப்போகுளோரசு அமிலம், குளோரிக்(I) அமிலம். குளோரனால், ஐதராக்சிடோகுளோரின் | |
| வேறு பெயர்கள்
ஐதரசன் ஐப்போகுளோரைட்டு, குளோரின் ஐதராக்சைடு | |
| இனங்காட்டிகள் | |
| 7790-92-3 | |
| ChEBI | CHEBI:24757 |
| ChemSpider | 22757 |
| EC number | 232-232-5 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24341 |
SMILES
| |
| UNII | 712K4CDC10 |
| பண்புகள் | |
| HOCl | |
| வாய்ப்பாட்டு எடை | 52.46 கி/மோல் |
| தோற்றம் | நிறமற்ற கரைசல் |
| அடர்த்தி | மாறக்கூடியது |
| கரையும் | |
| காடித்தன்மை எண் (pKa) | 7.53[1] |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | ஆக்சிசனேற்றி |
| தொடர்புடைய சேர்மங்கள் | |
| தொடர்புடைய சேர்மங்கள் | குளோரின் கால்சியம் ஐப்போகுளோரைட்டு சோடியம் ஐப்போகுளோரைட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
பயன்கள்
சேதனத் தொகுப்புகளில் HOCl ஆல்க்கீன்களை குளோரோடைரீன் ஆக மாற்றும்.[2]
உயிரியல் செயற்பாடுகளில் வினையூட்டப்பட்ட நடுவமைநாடிகளினால் தூண்டப்பட்ட உபகுளோரசு அமிலம் குளோரிட்டு பேரொட்சைட்டு அயன்களை ஆக்குவதால் அது பாக்டீரியாக்களை அழிக்கப் பயன்படும்.[3][4]
உருவாக்கம், நிலைத்திருப்பு, தாக்கங்கள்
நீருக்கு குளோரின் சேர்க்கப்படும் போது ஐதரோக்குளோரிக்கமிலம் , உபகுளோரசு அமிலம் ஆகிய இரண்டையும் அது தோற்றுவிக்கும்.[5]
- Cl2 + H2O

உபகுளோரசு அமிலத்தின் கரைசல் நிலை உப்புகளை (எ.கா: சோடியம் உபகுளோரசு) சேர்க்கும் போது இத்தாக்கம் இடப்பக்கமாக நகர்ந்து குளோரின் வாயுவைத் தரும். ஆகவே நிலையான உபகுளோரசு வெளிற்றிகள் குளோரின் வாயுவை நீரில் கரைந்த சோடியமைதரொட்சைட்டில் சேர்ப்பதன் மூலம் மேற்கொள்ளப்படுகின்றது.
இவ் அமிலம் இருகுளோரொவொட்சைட்டை நீரில் கரைப்பதன் மூலமும் உருவாக்கலாம். மாறா வெப்ப அமுக்க நிலைமைகளில் ஐதரசன் ஒட்சி குளோரைட்டை (உபகுளோரசு அமிலம்) தயாரிப்பது தாக்கச் சமநிலை உடனடியாக மீள்வதன் காரணமாக சாத்தியமற்றது.:[6]
- 2 HOCl

மேற்கோள்கள்
- Harris, Daniel C. (2009). Exploring Chemical Analysis, Fourth Edition. p. 538.
- Unangst, P. C. "Hypochlorous Acid" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. எஆசு:10.1002/047084289
- Harrison, J. E., and J. Schultz (1976). "Studies on the chlorinating activity of myeloperoxidase". Journal of Biological Chemistry 251 (5): 1371–1374. பப்மெட்:176150.
- Thomas, E. L. (1979). "Myeloperoxidase, hydrogen peroxide, chloride antimicrobial system: Nitrogen-chlorine derivatives of bacterial components in bactericidal action against Escherichia coli". Infect. Immun. 23 (2): 522–531. பப்மெட்:217834.
- Fair, G. M., J. Corris, S. L. Chang, I. Weil, and R. P. Burden (1948). "The behavior of chlorine as a water disinfectant". J. Am. Water Works Assoc. 40: 1051–1061.
- Inorganic chemistry, Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman , "Hypochlorous acid" p.442 , section 4.3.1