நீர்க்கரைசல்
நீர்க்கரைசல் (Aqueous solution) என்பது தண்ணீரைக் கரைப்பானாகக் கொண்டு உருவான ஒரு கரைசலாகும். வேதிச் சமன்பாடுகளில் மூலக்கூற்று வாய்ப்பாடுக்குப் பக்கத்தில் (aq) என்று குறியிட்டு குறிப்பிட்ட அவ்வேதிப்பொருள் ஒரு நீர்க்கரைசல் என்று அடையாளப்படுத்துவார்கள். உதாரணமாக சோடியம் குளோரைடின் நீர்க்கரைசலை NaCl(aq) என்று எழுதுவார்கள். இவ்விடத்தில் நீர் என்ற சொல்லானது நீருடன் தொடர்புடைய அல்லது நீருக்கு இணையான அல்லது நீரில் கரைந்துள்ள என்ற பொருளில் கையாளப்படுகிறது. தண்ணீர் ஒரு சிறந்த கரைப்பான் என்பதாலும் இயற்கையில் அதிகமாக கிடைக்கிறது என்பதாலும் வேதியியல் எங்கிலும் கரைப்பானாகப் பயன்படுகிறது.
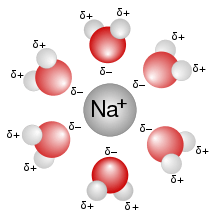
நீர் விலக்கும் வேதிப்பொருட்கள் பெரும்பாலும் தண்ணீரில் கரைவதில்லை ஆனால் நீர்விரும்பும் பொருட்கள் நன்றாகக் கரைகின்றன. உதாரணம்:சோடியம் குளோரைடு. அமிலங்கள் மற்றும் காரங்கள் அறீனீயசு வரையறைகளின் அடிப்படையில் நீர்க்கரைசல்கள் ஆகும்.
நீர்மூலக்கூறுகள் தங்களுக்குள் உண்டாக்குகிற வலுவான கவர்ச்சி விசைகளை எதிர்கொண்டு வெற்றி பெறுகின்ற அல்லது நீர்மூலக்கூறுகளுடன் பொருந்துகின்ற பொருட்கள் தண்ணீரில் கரைகின்றன. மாறாக இத்திறன் இல்லாதப் பொருட்கள் வீழ்படிவாக அடியில் தங்குகின்றன. நீர்க்கரைசல்களில் நடைபெறும் வினைகள் பொதுவாக இடப்பெயர்ச்சி வினைகளாக உள்ளன. இடப்பெயர்ச்சி வினைகள் என்பவை இரட்டை இடப்பெயர்ச்சி வினையைக் குறிக்கின்ற மற்றொரு பெயாராகும். அதாவது, ஒரு நேர்மின் அயனி இடம்பெயர்ந்து ஒரு எதிர்மின் அயனியுடன் பிணைந்து அயனிப்பிணைப்பை உருவாக்குகிறது. அதே நேர்மின் அயனி பிரிந்து மீண்டும் வேறொரு எதிர்மின் அயனியுடன் பிணைகிறது.
நீர்க்கரைசல்கள் வலுவான மின்பகுளிகளாகச் செயல்பட்டு மின்சாரத்தை நன்கு கடத்துகின்றன. மின்சாரத்தை நன்கு கடத்தாத கரைசல்கள் பலவீன்மான மின்பகுளிகள் எனப்படுகின்றன. வலிமையான மின்பகுளியில் பொருட்கள் முழுமையாக அயனியாகின்றன. வலிமையற்ற மின்பகுளிகளில் உள்ள பொருட்கள் முழுமையாக அயனியாவதில்லை.
மின்கடத்தா கரைசல்களில் பொருட்கள் கரைசலில் கரைந்திருந்தாலும் அவை மூலக்கூறுகளின் ஒருமைப்பாட்டை பேணுகின்றன. அவை அயனிகளாகப் பிரிகை அடைவதில்லை. உதாரணம்: சர்க்கரை, யூரியா, கிளிசரால் மற்றும் மெத்தில்சல்போனைல்மீத்தேன்.
நீர்க்கரைசல்கள் பங்கேற்கும் வேதிச் சமன்பாடுகளை எழுதும் பொழுது வீழ்படிவுகளை கண்டறிவது முக்கியமானதாகும். இதைக் கண்டறிய கரைதிறன் அட்டவனையை பார்க்க வேண்டிய அவசியம் விளைகிறது. கரைகின்ற சேர்மங்கள் நீர்க்கரைசல்களாகும். கரையாதச் சேர்மங்கள் வீழ்படிவுகளாகும். ஆனாலும் அவை எப்பொழுதும் வீழ்படிவாகவே இருப்பதில்லை என்பதையும் கவனிக்க வேண்டும்.
நீர்க்கரைசல் தொடர்பான கணக்கீடுகளைச் செய்யும் போது நீர்க்கரைசல்களின் அடர்த்தி அல்லது மோலார் எண்ணை அறிந்து கணக்கிட்டைச் செய்யவேண்டும்.
மேற்கோள்கள்
- Zumdahl S. 1997. Chemistry. 4th ed. Boston: Houghton Mifflin Company. p 133-145.
இவற்றையும் காண்க
- நீர்க்கரைசல்களில் உலோக அயனிகள்
- கரைதிறன்
- பிரிகை (வேதியியல்)
- அமிலம்-காரம் வினைக் கோட்பாடுகள்
- தண்ணீரின் பண்புகள்