அயனி
அயனி (Ion) என்பது ஏற்றம் பெற்ற அணு அல்லது அணுக்கூட்டத்தைக் குறிக்கின்றது. அயனி ஈழத்தில் அயன் என்றும் வழங்கப்படுகிறது. வேதியியல் அல்லது இயற்பியல் செயல்பாடுகளின் மூலமாக அயனிகளை உருவாக்க இயலும். அணுக்கள் இயற்கையில் தம் உறுதி நிலையைப் பேணுவதற்காக தங்கள் அணு அமைப்பின் மேலோட்டிலுள்ள எலக்ட்ரான்களை இழந்தோ ஏற்றோ அயனியாக்கம் அடைகின்றன. அயனிகளில் புரோட்டான்களின் எண்ணிக்கையை விட எலக்ட்ரான்களின் எண்ணிக்கை அதிகமாகக் காணப்படும்.
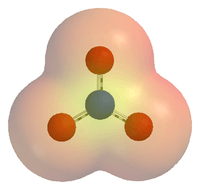
3). தனியொழுக்கு கொண்ட சமவழுத்தத்தைக் காட்டும் முப்பரிமாண கட்டமைப்பு.
வகைகள்
பொதுவாக அயனிகள் இரண்டு வகைப்படும். அவை 1. எதிர்மின் அயனி 2. நேர்மின் அயனி.
எதிர்மின் அயனி
எதிர்மின் அயனிகள் (Anions) என்பவை எலக்ட்ரான்களைக் கூடுதலாகப் பெற்றுள்ள அணுக்கள் அல்லது அணுக்களின் குழுக்களைக் குறிக்கும் உறுப்புகள் ஆகும். எதிர்மின் அயனிகளில் புரோட்டான்களைவிட எலக்ட்ரான்கள் எண்ணிகையில் மிகுந்திருக்கும். இவ்வயனிகள் எதிர்மின் சுமையைக் கொண்டிருக்கும்.
உதாரணமாக குளோரைடு அயனிகள் Cl- என்றும் புரோமைடு அயனிகள் Br- என்றும் அயோடைடு அயனிகள் I- என்றும் குறிக்கப்படுகின்றன. இவையாவும் ஒற்றை இணைதிறன் கொண்டு ஒரேயொரு ஐதரசன் அணுவுடன் இணையும் வல்லமை கொண்ட எதிர்மின் அயனிகள் ஆகும். இதைப்போலவே இணைதிறன் இரண்டு கொண்ட எதிர்மின் அயனிகள், இணைதிறன் மூன்று கொண்ட எதிர்மின் அயனிகள் எனப்பலவகை எதிர்மின் அயனிகள் உள்ளன.
நேர்மின் அயனி
நேர்மின் அயனிகள் (Cations) என்பவை புரோட்டான்களைக் கூடுதலாகப் பெற்றுள்ள அணுக்கள் அல்லது அணுக்களின் குழுக்களைக் குறிக்கும் உறுப்புகள் ஆகும்.. நேர்மின் அயனிகளில் எலக்ட்ரான்களைவிட புரோட்டான்கள் எண்ணிகையில் மிகுந்திருக்கும். இவ்வயனிகள் எதிர்மின் அயனிகளுக்கு எதிரான நேர்மின் சுமையைக் கொண்டிருக்கும்.
உதாரணமாக ஐதரசன் அயனி H+ என்றும் சோடியம் அயனி Na+ என்றும் லித்தியம் அயனி Li+ என்றும் குறிக்கப்படுகின்றன. இவையாவும் ஒற்றை இணைதிறன் கொண்ட அயனிகள் ஆகும். இவற்றைப் போலவே இணைதிறன் இரண்டு கொண்ட நேர்மின் அயனிகள், இணைதிறன் மூன்று கொண்ட நேர்மின் அயனிகள் எனப்பலவகை நேர்மின் அயனிகள் உள்ளன.
அயனியாதல்
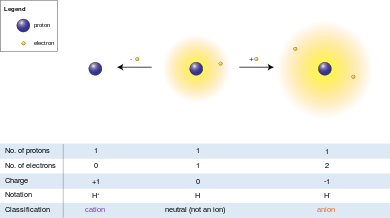
நடுநிலையான ஒர் அணு ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களை இழந்தால் அது ஒட்டுமொத்தமாக நேர்மின் சுமையைப் பெறுகிறது. எலக்ட்ரான்களைவிட இங்கு புரோட்டான்கள் அதிகமாக இருப்பதால் இவ்வயனி நேர்மின் அயனி எனப்படுகிறது[1].
- சோடியம் அணு. இதன் வெளிக்கூட்டில் ஒரே ஒரு தனி எலக்ட்ரான் உள்ளது. மற்றைய உட்கூடுகள் முறையே 2, 8 எலக்ட்ரான்கள் கொண்டு நிரம்பிக் காணப்படுகின்றன.எனவே வெளிக்கூட்டிலுள்ள ஒற்றை எலக்ட்ரானை இழந்து சோடியம் எளிதாக Na+ அயனியாகிறது.
- Na → Na+
+ e−
நடுநிலையான ஒர் அணு ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களைப் பெற்றுக்கொண்டால் அது ஒட்டுமொத்தமாக எதிர்மின் சுமையைப் பெறுகிறது[2]. எலக்ட்ரான்கள் இங்கு புரோட்டான்களைவிட அதிகமாக இருப்பதால் இவ்வயனி எதிர்மின் அயனி எனப்படுகிறது.
- குளோரின் அணு. இதன் வெளிக்கூட்டில் ஏழு எலக்ட்ரான்கள் உள்ளன. ஏழு எலக்ட்ரான்களை இழந்து உறுதியடைவதை விட ஒரு எலக்ட்ரானை ஏற்று தனது இறுதிக்கூட்டை நிரப்ப்பி உறுதியடைவது எளிதான செயலாகும். எனவே குளோரின் ஓர் எலக்ட்ரானை பெறுவதன் மூலம் Cl- அயனியாகிறது.
- Cl + e−
→ Cl−
ஒரே அணுவால் ஆன அயனி ஓரணு அயனி என்றும் ஒன்றுக்கு மேற்பட்ட அணுக்களைக் கொண்டிருக்கும் அயனி பல்லணு அயனி என்றும் அழைக்கப்படுகின்றன. அயனிகள் கொண்டுள்ள மின்சுமை காரணமாக அவை ஒன்றை ஒன்று ஈர்க்கின்றன. இதனால் உப்புகள் எனப்படும் அயனிச்சேர்மங்கள் உருவாகின்றன.
பொதுவான அயனிகள்
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
மேற்கோள்கள்
- Douglas W. Haywick, Ph.D. (2007–2008). "Elemental Chemistry". usouthal.edu.
- University of Colorado Boulder (November 21, 2013). "Atoms and Elements, Isotopes and Ions". colorado.edu.