அணு
அணு (![]()
| கீலியம் அணு | ||||||||
|---|---|---|---|---|---|---|---|---|
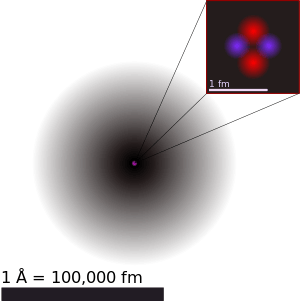 Helium atom ground state. | ||||||||
| வகுப்பு | ||||||||
| ||||||||
| Properties | ||||||||
|
அணுக்கள் மிகச் சிறியவையாக உள்ளதால் செவ்வியற்கால இயற்பியல் சரியற்ற முடிவுகளையே தந்தது. இயற்பியல் வளர வளர, நன்கு விளக்கி முன்கணிக்கும் குவைய நெறிமுறைகள் உருவாகின.
ஒவ்வொரு அணுவிலும் ஒரு மைய அணுக்கருவும் அதோடு கட்டுண்ட ஒன்று அல்லது அதற்கு மேற்பட்ட எதிர்மின்னிகளும் அமைந்துள்ளன. அணுக்கருவில் ஒன்று அல்லது அதற்கு மேற்பட்ட நேர்மின்னிகளும் அதையொத்த எண்ணிக்கையில் நொதுமிகளும் உள்ளன. நேர்மின்னிகளும் எதிர்மின்னிகளும் அணுக்கருனி எனப்படுகின்றன. ஏறக்குறைய 99.94% பொருண்மை அணுக்கருவிலேயே (nucleus) அமைந்துள்ளது. நேர்மின்னிகள் நேர்மின்னூட்டம் கொண்டுள்ளன. எதிர்மின்னிகள் எதிர்மின்னூட்டம் கொண்டுள்ளன. நொதுமிகள் மின்னூட்டம் அற்றவை. நேர்மின்னிகளும், எதிர்மின்னிகளுன் எண்ணிக்கையில் சம்மாக இருந்தால் அணு மின்னியலாக நொதுமல்நிலையில் அமையும். ஒரு அணுவில் நேர்மின்னிகளைவிட எதிர்மின்னிகளின் அளவு கூடினாலும் குறைந்தாலும் அணுவின் ஒட்டுமொத்த மின்னூட்டம் நேர் அல்லது எதிர்மின்னூட்டத்துடன் இருக்கும். இத்தகைய அணுக்கள் அயனிகள் எனப்படும்.
எதிர்மின்னிகள் அணுக்கருவில் உள்ள நேர்மின்னிகளால் மின்காந்த விசையால் ஈர்க்கப்படுகின்றன. அணுக்கருவில் உள்ள நேர்மின்னிகளும் நொதுமிகளும் ஒன்றோடொன்று வேறுவகைப்பட்ட அணுக்கரு விசையால் ஈர்க்கப்படுகின்றன. இது மின்காந்த விசையைவிட வலிமையானது. இது நேர்மின்னூட்டம் உள்ள நேர்மின்னிகளை நெருங்கிவிடாமல் பிரித்து விலக்குகிறது. சிலவேளைகளில் விலக்கும் இயல்புள்ள மின்காந்த விசை அணுக்கரு விசையைவிட வலிமையுற்று அணுக்கருவில் இருந்து அணுக்கருவன்களை வெளியேற்றும். இவ்வகை அணுக்கருச் சிதைவு, தனிம மாற்றத்தால் வேறுபட்ட தனிமத்தை மிஞ்சவைக்கும்.
அணுக்கருவில் உள்ள நேர்மின்னிகளின் எண்ணிக்கை அவ்வணு எந்த வேதித் தனிமத்தைச் சார்ந்த்து என்பதை முடிவு செய்கிறது: எடுத்துக்காட்டாக, அனைத்து செப்பு அணுக்களிளும் 29 நேர்மின்னிகளைக் கொண்டுள்ளன. நொதிமிகளின் எண்ணிக்கை அத்தனிமத்தின் ஓரிடத்தானை வரையறுக்கின்றன.[3] எதிர்மின்னிகளின் எண்ணிக்கை அணுவின் காந்த இயல்புகளை முடிவு செய்கிறது. அணுக்கள் வேதியியற் பிணைப்புகளால் ஒன்றோடொன்று இணைந்து மூலக்கூறு எனும் வேதிச் சேர்மத்தை உருவாக்கலாம். அணுவின் பிணையும் அல்லது பிரியும் திறமே நாம் இயற்கையில் பார்க்கும் இயற்பியல்/புரநிலை மாற்றங்களை ஏற்படுத்துகின்றன. இது வேதியியலால் ஆயப்படுகிறது.
புடவியின் அனைத்துப் பொருண்மமும் அணுக்களால் அமைவதில்லை. புடவியின் பெரும்பகுதி பொருண்மத்தைவிட (வானியல்)கரும்பொருளாலேயே அமைந்துள்ளது. அதாவது அணுக்களால் அமையாமல் நம்மால் இதுவரை அறியப்படாத துகள்களாலேயே அமைந்துள்ளது.
அணுக் கோட்பாட்டின் வரலாறு
மெய்யியலில் அணுக்கள்
பொருண்மம் தனித்த அலகுப் பொருட்கூறுகளால் ஆயது எனும் எண்ணக்கரு மிகமிகப் பழையதாகும். இது இந்திய, கிரேக்கச் சிந்தனைகளில் பழம்பெரும் பண்பாடுகளில் உருவாகியதாகும். உண்மையில் "atom" என்ற சொல் கிரேக்க மெய்யியலாளர்களால் உருவாக்கப்பட்டது. என்றாலும் இந்த எண்ணக்கரு மெய்யியல் அல்லது இறையியல் கருத்தோட்டங்களல் உருவாக்கப்பட்டதே தவிர சான்றாலும் செய்முறையாலும் நிறுவப்படவில்லை. எனவே அவர்களது அணுக்காட்சியும் இயக்கமும் சரியற்றனவே. மேலும் இக்கருத்தை அனைவராலும் ஏற்கவைக்க அவர்களால் முடியவில்லை. இதனால் பொருண்மம் பற்றிய பல்வேறு கோட்பாடுகளில் ஒன்றாகவே அணுக் கோட்பாடு அக்காலத்தில் நிலவியது. 19ஆம் நூற்றாண்டின் வேதியியல் கண்டுபிடிப்புகளுக்குப் பிறகே, இக்கருத்து ஏற்கப்பட்டு அறிவியலாளர்களால் வளர்த்தெடுக்கவும் நன்கு விளக்கவும் முடிந்தது.
முதல் சான்றுள்ள அணுக் கோட்பாடு

ஜான் டால்டன் 1800களில் அணு எனும் கருத்துப் படிமத்தை வேதித் தனிமங்கள் ஏன் குறிப்பிட்ட சிற்றெண் விகிதங்களில் வினைபுரிகின்றன என்பதை விளக்கப் பயன்படுத்தினார் (பன்மை விகிதங்கள் விதி). எடுத்துகாட்டாக, நடப்பில் இருவகை காரீய ஆக்சைடுகள் உள்ளன: ஒன்றில் 88.1% காரீயமும் 11.9% உயிரகமும் (oxygen) உள்ளன. மற்றொன்றில் 78.7% காரீயமும் 21.3% உயிரகமும் (oxygen) உள்ளன. இதன் பொருள் 100கி காரீயம் ஒன்று 13.5கி அல்லது 27கி உயிரகத்துடன் வினைபுரிகிறது. அதாவது 1:2 விகிதத்தில், ஒரு சிற்றெண் விகிதத்தில் வினைபுரிகிறது. வேதியியலின் இந்த பொது நடைமுறை தனிமங்கள் தன் தனி அலகுகளின் (அதாவது அணுக்களின்) முழு எண்ணிக்கைகளின் பன்மடங்கில் வினைபுரிகின்றன என்ற முடிவுக்கு வர வழிவகுத்தது. இந்த எடுத்துகாட்டில் ஒரு காரீய அணு ஒன்று அல்லது இரண்டு உயிரக அணுக்களோடு வினைபுரிகிறது.[4]
டால்டன் தண்ணீர் ஏன் பல்வேறு வளிமங்களை பல்வேறு விகிதங்களில் உறிஞ்சுகிறது என்பதையும் அணுக்கோட்பாட்டால் விளக்கமுடியும் என நம்பினார். எடுத்துகாட்டாக, தண்ணீர் கரிம ஈராக்சைடு வளிமத்தை காலக (nitrogen)வளிமத்தைவிட நன்றாக உறிஞ்சுவதைக் கண்டறிந்தார்.[5] இதற்குக் காரணம் அந்த வளிம மூலக்கூறுகளின் பொருண்மையும் சிக்கல்நிலையும் வேறுபடுவதே என டால்டன் விளக்கினார். உண்மையில் கரிம ஈராக்சைடு(CO2) காலக மூலக்கூறைவிட(N2) பெரியதும் எடைமிக்கதும் ஆகும். (N2).
பிரவுனிய இயக்கம்
இராபர்ட் பிரவுன் 1827இல் தண்ணிரில் மிதக்கும்/தவழும் தூசி மணிகளை நுண்ணோகி வழியாகப் பார்வையிட்டுள்ளார். அவை கண்டபடி தன்னியல்பில் இயங்குவதைக் கண்டுள்ளார். இப்போது இவ்வியடக்கம் "பிரவுனிய இயக்கம்" என அவரது பெயரால் வழஙப்படுகிறது. இது தண்ணீர் மூலக்கூறுகளால் தூசி மணிகள் தாக்கப்படுவதால் ஏற்படுவதாகக் கருதப்பட்டது. ஆல்பர்ட் அய்ன்சுடைன் 1905இல் முதன்முதலாகப் பிரவுனிய இயக்கத்தைக் கணிதவியலாக பகுப்பாய்வு செய்தார்.[6][7][8] பிரெஞ்சு இயற்பியலாளர்ழீன் பெரின் அய்ன்சுட்டீனின் ஆய்வைப் பயன்படுத்தி அணுக்களின் பொருண்மையையும் உருவளவையும் கண்டறிந்து அணுக் கோட்பாட்டை செய்முறை வழியாக உறுதிபட நிறுவினார்.[9]
நேர்மின்னி
நேர்மின் தன்மை கொண்டது. அணுவின் மையத்தில் இருக்கும். எடை 1.0073 amu. இதன் இயல்புகள்:
- நேர்க் கதிரின் e /m விகிதம் மாறிலி அன்று. ஆனால் குறித்த ஒரு நேர்க்கதிரை கருதும் போது அதன் e/m மாறிலி.
- இக்கதிர் நேர் ஏற்றம் பெற்றவை .
- நேர்க் கதிர்கள் பயணிக்கும் பாதையில் காந்தப் புலத்தை ஏற்படுத்தும் போது அவை கதோட்டுக்கதிர்கள் பயணிக்கும் பாதைக்கு எதிர் திசையிலும் காந்தபுலத்துக்கு செங்குத்தாக திரும்பலடையும்.
- நேர்க் கதிர்களுக்கு அலை இயல்பு உண்டு. அதாவது நேர்க் கதிர்கள் பயணிக்கும் பாதையில் ZnS பூசப்பட்ட திரையை வைக்கும் போது அது பிரகாசமாக ஒளிர்ந்தமை.
- நேர்க் கதிர்களுக்கு துணிக்கை இயல்பு உண்டு. அதாவது நேர்க் கதிர்கள் பயணிக்கும் பாதையில் சுழலும் பற்சக்கரத்தை வைக்கும் போது அது சுழன்றமை.எனவே நேர்க் கதிர்களுக்கு திணிவு ,வேகம் ,உந்தம் ,இயக்கசக்தி என்பன உண்டு.
நேர்க் கதிர்கள்.(p)
- ஒரு நடுநிலையான அணுவில் எதிர் ஏற்றம் பெற்ற துணிக்கைகள் காணப்படுவதால் நேர் ஏற்றம் பெற்ற துணிக்கைகளும் அணுக்களில் இருத்தல் வேண்டும் என்ற முடிவு Gold stein யினால் மேற்கொள்ளப்பட்டு கதோட்டுக் குழாய் பரிசோதிணை மீண்டும் செய்யப்பட்டது.இங்கு வழமையான கதோட்டுக்குப் பதிலாக hole cathode பயன்படுத்தப்பட்டது.
அவதானம்
- hole cathode யினூடாக கதோட்டுக்கதிர்கள் செல்லும் திசைக்கு எதிரான திசையில் சமாந்திரமாக செந்நிறக்கதிர்கள் சென்றதுடன் அவை நேர் ஏற்றம் பெற்றிருந்தமையால் நேர்க் கதிர்கள் என்றும் hole cathode யினூடாக சென்றமையால் கால்வாய் கதிர் எனவும் அழைக்கப்பட்டது.
நேர்க் கதிர்களின் உருவாக்கம்
- கதோடுக் கதிர்கள் கதோட்டில் ஆரம்பிப்பது போல் நேர்க் கதிர்கள் அனோட்டில் ஆரம்பிப்பது இல்லை.
- உயர் வேகத்துடன் செல்லுகின்ற / உயர் சக்தியுடன் செல்லுகின்ற கதோடுக் கதிர்கள் வாயு நிலை அணுவை / வாயு நிலை மூலக்கூறை மோதி அடிக்கும் இடத்திலேயே நேர்க் கதிர்கள் தோற்றம் பெறுகின்றன.
- நேர்க்கதிர்கள் எல்லாம் p கள் அல்ல. மின்னிறக்கக் குழாயினுள் ஐதரசன் வாயுவை எடுக்கும் போது பெறப்படும் நேர்த்துணிக்கை இலத்திரனின் ஏற்றத்திற்கு சமனாக அமைந்ததுடன் இந்த நேர்த்துணிக்கைகளின் மடங்குகளாகவே ஏனைய நேர்த்துணிக்கைகளின் திணிவுகள் அமைந்தமையால் இதுவே அடிப்படை துணிக்கையாக அமைய வேண்டும் என இரதபோர்ட் கண்டறிந்தவுடன் அதனை புரோத்திரன்கள் (p) எனவும் கண்டுபிடித்தார்.
எதிர்மின்னி
எதிர்மின் தன்மை கொண்டது. அணு மையத்தைச் சுற்றி சுழன்று வரும். புரோட்டானுக்கு சமமான மின்சக்தி இருந்தாலும், புரோட்டானை விட இரண்டாயிரம் மடங்கு எடை குறைவானது. எடை 0.000549 amu. இதன் இயல்புகள்:
- மறை ஏற்றம் கொண்டவை. அதாவது கதோட்டுக் கதிர்கள் பயணிக்கும் பாதையில் மின்புலத்தை ஏற்படுத்தும் போது அவை மின்புலத்தின் நேர்த்தட்டு பக்கம் திரும்பியமை.
- கதோட்டுக் கதிர்களுக்கு அலை இயல்பு உண்டு.அதாவது கதோட்டுக் கதிர்கள் பயணிக்கும் பாதையில் ZnS பூசப்பட்ட திரையை வைக்கும் போது அது பிரகாசமாக ஒளிர்ந்தமை.
- கதோட்டுக் கதிர்களுக்கு துணிக்கை இயல்பு உண்டு. அதாவது கதோட்டுக் கதிர்கள் பயணிக்கும் பாதையில் சுழலும் பற்சக்கரத்தை வைக்கும் போது அது சுழன்றமை.எனவே கதோட்டுக்க கதிர்களுக்கு திணிவு ,வேகம் ,உந்தம் ,இயக்கசக்தி என்பன உண்டு.
- கதோட்டுக்கதிர்கள் பயணிக்கும் பாதையில் உலோகத்ததட்டை வைக்கும் போது அவை X-கதிர் உருவாக்கும்.
- கதோட்டுக்கதிர்கள் பயணிக்கும் பாதையில் வாயு நிலை அணுவை / மூலக்கூறை வைக்கும் போது கதோட்டுகதிர்கள் மோதும் போது அங்கு நேர்துணிக்கைகள் தோற்றம் பெறும்.
- கதோட்டுக்கதிர்கள் பயணிக்கும் பாதையில் செஞ்சூடாக்கப்பட்ட உலோக இதழை வைக்கும் போது அது பிரகாசமாக ஒளிர்ந்தமை. எனவே கதோட்டுக்கதிர்களுக்கு உயர் சக்தி, வெப்பம் உண்டு.
- கதோட்டுக்கதிர்கள் அலை இயல்பையும், துணிக்கை இயல்பையும் ஒரே நேரத்தில் வெளிப்படுத்தும். அதாவது கதோட்டுக் கதிர்கள் பயணிக்கும் பாதையில் ZnS பூசப்பட்ட சுழலும் பற்சக்கரத்தை வைக்கும் போது அது ஒளிர்ந்து சுழன்றமை.
நொதுமின்னி
நேர்மின்னியும் , எலக்ட்ரானும் இணைந்தது. அதனால் மின்சக்தி சமனப்பட்டு சக்தியை வெளிப்படுத்தாமல் இருக்கும். கிட்டத்தட்ட நியூட்ரானின் எடை 1.0087amu. இது இல்லாமல் புரோட்டான், எலக்ட்ரான் மட்டும் கொண்ட அணு உண்டு.
அணுவின் கருவுக்கான முதலாவது மாதிரியுரு (இரதபோர்ட்)
- இம்மாதிரியுரு α கதிர் சிதறல் பரிசோதினை / பொற்தகட்டு பரிசோதினை விபரிக்கப்படுகிறது.
- Rathaford ம் அவரது மாணவர்களான கைகர், மாஸ்டனும் தடித்த Pb குற்றியினுள் α துணிக்கையினை காலல் செய்யக்கூடிய ஒரு முதலை வைத்து வெற்றிடத்தினூடாக அவ் α கதிர்கள் நேர்க்கோட்டில் செல்ல அனுமதிக்கப்பட்டன.பின்னர் அவற்றின் பாதையில் ஒரு மெல்லிய பொற்தகடு வைக்கப்பட்டு தொடர்ந்து α கதிர்கள் பாதை ஒரு நகரக்கூடிய புளோரொளிர்வு திரையின் உதவியுடன் / நகருகின்ற நுணுக்குக்காட்டியின் உதவியுடன் அவதானிக்கப்பட்டது.
- அவதானம் :-
- பெரும்பாலான α துணிக்கை எதுவித விலகலுமின்றி நேர்கோட்டில் சென்றன. முடிவு - அணுவின் பெரும்பகுதி வெற்றிடம்.
அணுவின் அளவு
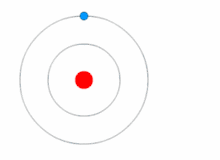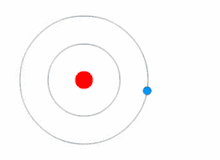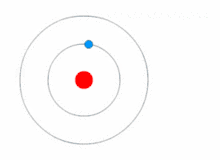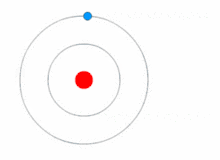
ஒரு எலக்ட்ரான், ஒரு புரோட்டான் மட்டும் கொண்ட மிகச்சிறிய அணுவான ஹைட்ரஜன் அணுவின் விட்டம் .,..,. உருவகப்படுத்தி பார்க்க வேண்டுமானால் 2 கோடி ஹைட்ரஜன் அணுக்களை ஒரு நேர்க்கோட்டில் வைத்தால் ஒரு மில்லிமீட்டர் நீளம் வரும்.
0 டிகிரி செல்சியசிலும் ஒரு வளிமண்டல அழுத்ததிலும் எல்லா வளிமங்களும் 22.4136 லிட்டர் கன அளவில் ஒரே எண்ணிக்கையில் அணுக்களையோ மூலக்கூறுகளையோ கொண்டிருக்கும். இவ்வெண் அவகாட்ரோ எண் எனப்படும்.18 கிராம் நீரின் கன அளவு 18 கன செனடி மீட்டராகும். இந்த கன அளவில் ( அவகாட்ரோ எண்) நீர் மூலக்கூறுகள் உள்ளன. நீரின் மூலக்கூறுகள் சரியான செவ்வக வடிவம் கொண்டவை என எடுத்துக் கொண்டால் ,அவைகளை சீராக அடுக்கும் போது மூலக்கூறுகளுக்கிடையே வெற்றிடம் இருக்க வாய்ப்பில்லை. எனவே ஒரு தனி மூலக்கூறின் பருமனளவு சி.சி என்று கொளலாம். இதற்குக் காரணம் கோளங்களை அடுத்தடுத்து வைக்கும் போது சிறு வெற்றிடம் அவைகளுக்கிடையே உள்ளது என்பது தான். கோளத்தின் பருமனளவு 4/3 π r 3 சி.சி ஆகும்.இதிலிருந்து நீர் மூலக்கூற்றின் ஆரம் செ.மீ. என்று கொள்ளலாம்.அணுவின் ஆரம் எந்த அளவு இருக்கக்கூடும் என்பதனைக் காட்டுகிறது. சில அணுக்களின் ஆரம், ஐட்ரசன் .053 நானோ மீட்டர். ஆக்சிஜன் .074 ; கரி .077 ;; ஆர்சனிக் .12 ; ; தகரம் .14 ; ; அலுமினியம் .145 ;; ஈயம் .175 ;; சோடியம் .19 ;; பொட்டாசியம் .0225 ;; என்று கணித்திருக்கிறார்கள்.
அணு எண்
அணுவில் உள்ள நேர்மின்னிகளின் எண்ணிக்கை அணு எண் எனப்படுகிறது. இதுவே அணுக்களை வரிசைப்படுத்த உதவும் குணமாகும். ஒரு தனிமத்தின் அணுக்கள் அனைத்தும் ஒரே அணு எண்ணைக் கொண்டிருக்கும்.
பண்புகள்
ஒரே அளவான நேர்மின்னிகளைக் கொண்ட அணுக்களின் கூட்டம் தனிமம் எனப்படும். உதாரணமாக தூய ஐதரசன் வாயு மாதிரியொன்றில் ஒரு நேர்மின்னியைக் கொண்ட அணுக்களே காணப்படும். ஒரே அளவான நேர்மின்னிகளைக் கொண்ட அணுக்கள் ஒரே விதமான இரசாயன இயல்பைக் காட்டுவதே இதற்குக் காரணமாகும். எனவே ஒரு அணுக்கூட்டத்தில் வெவ்வேறு எண்ணிக்கையில் நியூத்திரன்கள் காணப்பட்டாலும் ஒரே எண்ணிக்கையில் நேர்மின்னிகள் காணப்படின் அவை ஒரே தனிம வகையைச் சேர்ந்தவையாகும். வெவ்வேறு நியூத்திரன் எண்ணிக்கையைக் கொண்ட ஒரே தனிம வகையைச் சேர்ந்த அணுக்கள் சமதானிகள்/ ஓரிடத்தான்கள் எனப்படும். உதாரணமாக ஐதரசனில் முறையே 0,1,2 என நியூத்திரன் எண்ணிக்கையுடைய புரோட்டியம், டியூத்திரியம், டிரைடியம் என்ற சமதானிகள் உள்ளன (இவை அனைத்திலும் ஒரு அணுவுக்கு ஒரு நேர்மின்னியே உள்ளது). இதுவரை ஐதரசனிலிருந்து அன்அன்ஆக்டியம் வரையான 118 தனிமங்கள் அறியப்பட்டுள்ளன. இவற்றில் அணு எண் 82க்கு மேற்பட்ட அணுக்கள் கதிரியக்கம் உடையவை. புவியில் ஏறத்தாழ 339 இயற்கையான அணுக்கருக்கள் உள்ளன. இவற்றில் 254 அணுக்கருக்களில் கதிரியக்கம் அவதானிக்கப்படவில்லை. எனவே இவை நிலையான அணுக்கருக்கள் எனப்படுகின்றன. கதிரியக்கம் உள்ளவற்றில் 34 அணுக்கருக்கள் சிறிதளவான கதிரியக்கத்தையே உடையவை.
திணிவு
அணுக்களின் மொத்தத் திணிவில் பெரும் பங்கை நேர்மின்னிகளும் நொதுமிகளுமே (நியூத்திரன்) ஆக்கின்றன. எனவே ஒரு அணுவில் நேர்மின்னிகள் மற்றும் நொதுமிகளின் மொத்த எண்ணிக்கை திணிவெண் எனப்படுகின்றது. உதாரணமாக கார்பன்-14 இல் திணிவெண் 14 ஆகும் (6நேர்மின்னி+8நொதுமி). சாதாரண அலகுகளில் அணுவின் திணிவு மிகச் சிறியதாகும். எனவே அணுவின் திணிவு அணுத் திணிவலகு (u) அல்லது டால்டன்களில் (Da) அளவிடப்படுகின்றது. ஒரு அணுத்திணிவலகு கார்பன்-12 சமதானியின் பன்னிரண்டில் ஒரு பங்கு திணிவாகும். இது கிட்டத்தட்ட 1.66×10−27 kg (கிட்டத்தட்ட ஒரு ஐதரசன் அணுவின் திணிவு) ஆகும். எனவே கணிப்புகளின் போது கடினத்தன்மை குறைக்கப்படுகின்றது. உதாரணமாக ஈயத்தின் திணிவு அணுத் திணிவலகில் 207.9766521 u (கிட்டத்தட்ட 208 u) ஆகும். விஞ்ஞானத்தில் பரிசோதனைகளை இலகுவாக்க மூல் எனும் அலகு பயன்படுகின்றது. 6.022×1023 எண்ணிக்கையான அணுக்களின் திணிவே மூல் எனப்படும். உதாரணமாக 12u திணிவுடைய 6.022×1023 கார்பன் அணுக்களின் ஒரு மூல் 12 g ஆகும்.
மேற்கோள்கள்
- "Atom". Compendium of Chemical Terminology (IUPAC Gold Book) (2nd). IUPAC. அணுகப்பட்டது 2015-04-25.
- Ghosh, D. C.; Biswas, R. (2002). "Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii". Int. J. Mol. Sci. 3: 87–113. doi:10.3390/i3020087.
- Leigh, G. J., தொகுப்பாசிரியர் (1990). International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry, Nomenclature of Organic Chemistry – Recommendations 1990. Oxford: Blackwell Scientific Publications. பக். 35. பன்னாட்டுத் தரப்புத்தக எண்:0-08-022369-9. "An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements."
- Andrew G. van Melsen (1952). From Atomos to Atom. Mineola, N.Y.: Dover Publications. பன்னாட்டுத் தரப்புத்தக எண்:0-486-49584-1.
- Dalton, John. "On the Absorption of Gases by Water and Other Liquids", in Memoirs of the Literary and Philosophical Society of Manchester. 1803. Retrieved on August 29, 2007.
- Einstein, Albert (1905). "Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen" (in German) (PDF). Annalen der Physik 322 (8): 549–560. doi:10.1002/andp.19053220806. Bibcode: 1905AnP...322..549E. http://www.zbp.univie.ac.at/dokumente/einstein2.pdf. பார்த்த நாள்: 4 February 2007.
- Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. பக். 1–7. பன்னாட்டுத் தரப்புத்தக எண்:0-19-851567-7. இணையக் கணினி நூலக மையம்:48753074.
- Lee, Y.K. (1995). "Brownian Motion". லண்டன் இம்பீரியல் கல்லூரி. மூல முகவரியிலிருந்து 18 December 2007 அன்று பரணிடப்பட்டது. பார்த்த நாள் 18 December 2007.
- Patterson, G. (2007). "Jean Perrin and the triumph of the atomic doctrine". Endeavour 31 (2): 50–53. doi:10.1016/j.endeavour.2007.05.003. பப்மெட்:17602746.
வெளி இணைப்புகள்
- யூடியூபில் s_HEUHyoZWI "Quantum Mechanics and the Structure of Atoms"
- Freudenrich, Craig C.. "How Atoms Work". How Stuff Works. மூல முகவரியிலிருந்து 8 January 2007 அன்று பரணிடப்பட்டது. பார்த்த நாள் 9 January 2007.
- "The Atom". Free High School Science Texts: Physics. Wikibooks. பார்த்த நாள் 10 July 2010.
- Anonymous (2007). "The atom". Science aid+. பார்த்த நாள் 10 July 2010.—a guide to the atom for teens.
- Anonymous (3 January 2006). "Atoms and Atomic Structure". BBC. மூல முகவரியிலிருந்து 2 January 2007 அன்று பரணிடப்பட்டது. பார்த்த நாள் 11 January 2007.
- Various (3 January 2006). "Physics 2000, Table of Contents". University of Colorado. மூல முகவரியிலிருந்து 14 January 2008 அன்று பரணிடப்பட்டது. பார்த்த நாள் 11 January 2008.
- Various (3 February 2006). "What does an atom look like?". University of Karlsruhe. பார்த்த நாள் 12 May 2008.