ஆர்செனிக் அமிலம்
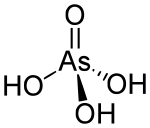
ஆர்செனிக் அமிலம் (Arsenic acid) என்பது H3AsO4 என்ற மூலக்கூறு வாய்பாடுடன் கூடிய ஒரு வேதிச் சேர்மமாகும். இம்மூலக்கூறு வாய்பாடு AsO(OH)3, என்று மேலும் விரிவாகவும் எழுதப்படுகிறது. நிறமற்ற இவ்வமிலத்தின் பண்புகள் பாசுபாரிக் அமிலத்தின் பண்புகளை ஒத்திருக்கிறது. ஆர்செனேட்டு மற்றும் பாசுபேட்டு உப்புகள் ஒரே மாதிரியான செயல்பாடுகளைக் கொண்டுள்ளன. ஆர்செனிக் அமிலத்தை தனிமைப்படுத்த முடியாது ஆனால் கரைசலாகக் கிடைக்கிறது. அமிலநிலையில் இது அதிக அளவில் அயனியாகிறது. இதனுடைய அரைநீரேறி வடிவம் (H3AsO4·½H2O) நிலையான படிகமாகக் காணப்படுகிறது. 100°செ வெப்பநிலையில் படிகவடிவ மாதிரிகளின் நீர்நீக்கப்படுகிறது.[1]
 | |
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
ஆர்செனிக் அமிலம், ஆர்சோரிக் அமிலம் | |
| வேறு பெயர்கள்
ஆர்செனிக் அமிலம் ஆர்த்தோ ஆர்செனிக் அமிலம் ஈரமுறிஞ்சி எல்-10 சோடாக்சு | |
| இனங்காட்டிகள் | |
| 7778-39-4 | |
| ChEBI | CHEBI:18231 |
| ChemSpider | 229 |
| EC number | 231-901-9 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| KEGG | C01478 |
| வே.ந.வி.ப எண் | CG0700000 |
SMILES
| |
| UNII | N7CIZ75ZPN |
| பண்புகள் | |
| H3AsO4 | |
| வாய்ப்பாட்டு எடை | 141.94 கி/மோல் |
| தோற்றம் | வெண்மை நிற் படிகங்கள், நீரை உறிஞ்சும். |
| அடர்த்தி | 2.5 g/cm3 |
| உருகுநிலை | |
| கொதிநிலை | 120 °C (248 °F; 393 K) |
| 16.7 கி/100 மி.லி | |
| கரைதிறன் | ஆல்ககாலில்கரையும் |
| ஆவியமுக்கம் | 55 hPa (50 °செ) |
| காடித்தன்மை எண் (pKa) | 2.19, 6.94, 11.5 |
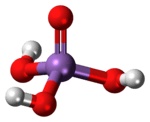
| கட்டமைப்பு | |
| மூலக்கூறு வடிவம் | |
| தீங்குகள் | |
| ஈயூ வகைப்பாடு | Toxic (T) சுற்றுச்சூழலுக்கு அபாயமானது (N) |
| R-சொற்றொடர்கள் | R23/25, R45, R50/53 |
| S-சொற்றொடர்கள் | S53, S45, S60, S61 |
| தீப்பற்றும் வெப்பநிலை | சுவாலையுடன் எரியாது |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose) |
48 மி.கி/கி.கி (எலி,வாய்வழி) |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | பாசுபாரிக் அமிலம் |
| ஏனைய நேர் மின்அயனிகள் | சோடியம் ஆர்செனேட்டு |
| தொடர்புடைய சேர்மங்கள் | ஆர்செனசு அமிலம் ஆர்செனிக் ஐந்தாக்சைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
பண்புகள்
ஆர்செனிக் அமில மூலக்கூறு, தனித்துவம் மிக்க நாற்பட்டகச் சமச்சீர்மை C3v தோற்றம் கொண்டுள்ளது. As–O பிணைப்பு நீளம் 1.66 முதல் 1.71 Å[2] வரையிலான அளவுகளில் காணப்படுகிறது
ஒரு முப்புரோட்டிக் அமிலமாக இருப்பதால் இதனுடைய அமிலத்தன்மையும் முச்சமநிலையில் உள்ளதாக விவரிக்கப்படுகிறது.
- H3AsO4 + H2O

4 + H3O+ (K1 = 10−2.19)
- H2AsO−
4 + H2O
4 + H3O+ (K2 = 10−6.94)
- HAsO2−
4 + H2O
4 + H3O+ (K3 = 10−11.5)
இதனுடைய அமிலத்தன்மை எண் Ka மதிப்பு பாசுபாரிக் அமிலத்தின் மதிப்பிற்கு நெருக்கமாக உள்ளது. மூன்றாவது அயனியாக்கும் ஆற்றலில் தோன்றும் ஆர்செனேட்டு அயனி அதிகக் காரத்தன்மையுடன் காணப்படுகிறது. மேலும் இவ்வமிலம் பாசுபாரிக் அமிலத்தைப் போலல்லாமல் சிறந்த ஆக்சிசனேற்றியாக செயல்படுகிறது. அயோடைடை அயோடினாக மாற்றும் வினை இதற்குச் சான்றாகக் கருதப்படுகிறது.
தயாரிப்பு
ஆர்செனிக் மூவாக்சைடை அடர் நைட்ரிக் அமிலம் மற்றும் இருநைட்ரசன் மூவாக்சைடுடன் சேர்த்து வினைப்படுத்தினால் உடன் விளைபொருளாக ஆர்செனிக் அமிலம் தயாரிக்கப்படுகிறது.[3].
- As2O3 + 2 HNO3 + 2 H2O → 2 H3AsO4 + N2O3
இறுதியாக இவ்வினையில் தோன்றும் கரைசலை குளிர்வித்தால் ஆர்செனிக் அமிலத்தின் நிறமற்ற அரைநீரேறி படிகங்கள் H3AsO4·½H2O உருவாகின்றன. ஆனாலும் குறைந்த வெப்பநிலைகளில் படிகமாகும் போது இவ்வமிலத்தின் இருநீரேறி H3AsO4·2H2O உற்பத்தியாகிறது[3].
பிற தயாரிப்பு முறைகள்
ஆர்செனிக் ஐந்தாக்சைடு நீரில் கரையும்பொழுது ஆர்செனிக் அமிலம் மெதுவாக உருவாகிறது. மெட்டா நிலை அல்லது பைரோ ஆர்செனிக் அமிலத்தை நீரில் கரைக்கும்பொழுதும் ஆர்செனிக் அமிலம் உண்டாகிறது. இம்முறைகளைத் தவிர நேரடியாக ஈரமான ஆர்செனிக்கை ஓசோனுடன் வினைப்படுத்தியும் ஆர்செனிக் அமிலம் தயாரிக்கலாம்.
- 2 As + 3 H2O + 5 O3 → 2 H3AsO4 + 5 O2
பயன்கள்
ஆர்செனிக் அமிலத்தின் நச்சுத் தன்மை காரணமாக இதனுடைய வர்த்தகவகை பயன்பாடுகள் கட்டுப்படுத்தப்படுகிறது, சில வேளைகளில் ஆர்செனிக் அமிலம் மரப்பாதுகாப்புப் பொருள், அகல நிரல் உயிர்கொல்லி, உலோக மற்றும் கண்ணாடி தயாரிப்பு வினைகளில் இறுதி முடிப்பு முகவர் , சிலவகை சாயப்பொருட்கள் தொகுப்பு வினைகளில் வினையூக்கி என பலவாறு பயன்படுத்தப்படுகிறது. முயல்கள் மீதான ஆர்செனிக் அமிலத்தின் LD50 நச்சுத்தன்மை மதிப்பு 6 மி.கி/கி.கி அல்லது 0.006கி/கி.கி ஆகும்.[4]
மேற்கோள்கள்
- Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. பன்னாட்டுத் தரப்புத்தக எண்:0-12-352651-5.
- Lee, C.; Harrison, W. T. A. (2007). "Tetraethylammonium dihydrogenarsenate bis(arsenic acid) and 1,4-diazoniabicyclo[2.2.2]octane bis(dihydrogenarsenate) arsenic acid: hydrogen-bonded networks containing dihydrogenarsenate anions and neutral arsenic acid molecules". Acta Crystallographica C 63 (Pt 7): m308–m311. doi:10.1107/S0108270107023967. பப்மெட்:17609552.
- G. Brauer, தொகுப்பாசிரியர் (1963). "Arsenic Acid". Handbook of Preparative Inorganic Chemistry. 1 (2nd ). New York: Academic Press. பக். 601.
- Joachimoglu, G. (1915). Biochemische Zeitschrift 70: 144.