இருநைட்ரசன் மூவாக்சைடு
இருநைட்ரசன் மூவாக்சைடு (Dinitrogen trioxide) என்பது N2O3.என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். இரட்டை நைட்ரசன் ஆக்சைடுகளில் ஒன்றான இச்சேர்மம் ஆழ்ந்த நீலநிறத்துடன் திண்மமாகக் காணப்படுகிறது[1]. நைட்ரிக் ஆக்சைடு மற்றும் நைட்ரசன் ஈராக்சைடு இரண்டையும் சம அளவுகளில் கலந்து - 21 °செ வெப்பநிலைக்கு குளிர வைப்பதன் மூலமாக இருநைட்ரசன் மூவாக்சைடைத் தயாரிக்கலாம்.:[2]
- NO + NO2

 | |
 | |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
நைட்ரசு நீரிலி, நைட்ரசன் செசுகியுவாக்சைடு | |
| இனங்காட்டிகள் | |
| 10544-73-7 | |
| ChEBI | CHEBI:29799 |
| ChemSpider | 55446 |
| EC number | 234-128-5 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 61526 |
SMILES
| |
| பண்புகள் | |
| N2O3 | |
| வாய்ப்பாட்டு எடை | 76.01 கி/மோல் |
| தோற்றம் | ஆழ்ந்த நீலநிறத் திரவம் |
| அடர்த்தி | 1.447 கி/செ.மீ3, திரவம் 1.783 கி/செ.மீ3 (வாயு) |
| உருகுநிலை | |
| கொதிநிலை | 3.5 °C (38.3 °F; 276.6 K)(பிரிகையடைகிறது[1]) |
| நன்றாகக் கரையும் | |
| கரைதிறன் | ஈதரில் கரையும் |
| கட்டமைப்பு | |
| மூலக்கூறு வடிவம் | |
| இருமுனைத் திருப்புமை (Dipole moment) | 2.122 D |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
+91.20 கியூ/மோல் |
| நியம மோலார் எந்திரோப்பி S |
314.63 யூ கெ−1 மோல்−1 |
| வெப்பக் கொண்மை, C | 65.3 யூ/மோல் கெ |
| தீங்குகள் | |
| ஈயூ வகைப்பாடு | அதிகமான நச்சு (T+) |
| தீப்பற்றும் வெப்பநிலை | எளிதில் தீப்பற்றது. |
| தொடர்புடைய சேர்மங்கள் | |
| நைட்ரசன் ஆக்சைடுகள் தொடர்புடையவை |
நைட்ரசு ஆக்சைடு நைட்ரிக் ஆக்சைடு நைட்ரசன் ஈராக்சைடு இருநைட்ரசன் நான்காக்சைடு இருநைட்ரசன் ஐந்தாக்சைடு நைட்ரசன் மூவாக்சைடு |
| தொடர்புடைய சேர்மங்கள் | நைட்ரசு அமிலம் |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
தாழ் வெப்பநிலைகளில் அதாவது நீர்ம மற்றும் திண்ம நிலைகளில் இருநைட்ரசன் மூவாக்சைடு மட்டுமே தனித்துப் பிரிக்கக் கூடியதாக உள்ளது. உயர் வெப்பநிலைகளில் வேதிச்சமநிலை இச்சேர்மத்தின் பகுதிப்பொருட்களாய் உள்ள வாயுக்களுக்கு சாதகமாக இருக்கிறது. Kபிரிகை = 193 kPa (25 °செ).[3]
அமைப்பும் பிணைப்பும்
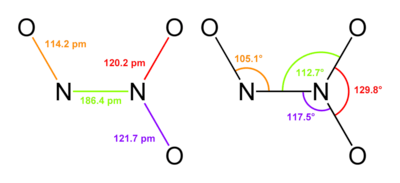
குறிப்பாக N–N பிணைப்புகள் ஐதரசீனில் இருப்பது போல (145 பிக்கோமீட்டர்) பிணைப்பு நீளம் கொண்டுள்ளன. எனினும் இருநைட்ரசன் மூவாக்சைடில் வழக்கத்திற்கு மாறாக நீளமான N–N பிணைப்புகள் 186 பிக்கோமீட்டர் நீளமும் பெற்றிருப்பதுண்டு. இருநைட்ரசன் நான்காக்சைடு போன்ற சில நைட்ரசன் ஆக்சைடுகளும் 175 பிக்கோமீட்டர் நீளமுள்ள பிணைப்புகளுடன் உள்ளன. N2O3 மூலக்கூறானது சமதள அமைப்புடன் Cs சீரொழுங்கை வெளிப்படுத்துகிறது. இங்கு காட்டப்பட்டுள்ள பரிமாணங்கள் , வாயுநிலை N2O3 இன் தாழ் வெப்பநிலை நுண்ணலை அலைமாலையியல் அமைப்பாகும்:[2]
.
நீருடன் கலக்கும் போது உருவாகும் இச்சேர்மம், நிலைப்புத் தன்மையற்ற நைட்ரசு அமிலத்தின் நீரிலி வடிவமாகும். மாறாக, உண்மையான நீரிலி வடிவத்தின் O=N–O–N=O அமைப்புடன் ஒருவகையும் எதிர்நோக்கப்படுகிறது. ஆனால், இவ்வமைப்பில் மாற்று வடிவம் ஏதும் அறியப்படவில்லை. நைட்ரசு அமிலம் உடனடியாகப் பயன்படுத்தப்படாவிட்டால் அது நைட்ரிக் ஆக்சைடு மற்றும் நைட்ரிக் அமிலமாக சிதைவடைந்து விடுகிறது. இருநைட்ரசன் மூவாக்சைடை காரக் கரைசல்களுடன் சேர்த்தால் சிலசமயங்களில் நைட்ரைட்டு உப்புகள் தோன்றுகின்றன.
- N2O3 + 2 NaOH → 2 NaNO2 + H2O
மேற்கோள்கள்
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth–Heinemann. பக். 444. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. பக். 521–22. பன்னாட்டுத் தரப்புத்தக எண்:0-08-022057-6. http://books.google.co.nz/books?id=OezvAAAAMAAJ&q=0-08-022057-6&dq=0-08-022057-6&source=bl&ots=m4tIRxdwSk&sig=XQTTjw5EN9n5z62JB3d0vaUEn0Y&hl=en&sa=X&ei=UoAWUN7-EM6ziQfyxIDoCQ&ved=0CD8Q6AEwBA.
- Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
வெளி இணைப்புகள்
- National Pollutant Inventory - Oxides of nitrogen fact sheet
- Webelements: Compound data - dinitrogen trioxide
- Oxides of nitrogen - synthesis and uses
- Ivtantermo - dinitrogen trioxide table of values