இருகுளோரின் ஓராக்சைடு
இருகுளோரின் ஓராக்சைடு (Dichlorine monoxide) ஓராக்சைடு என்பது Cl2O என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். இச்சேர்மம் முதன்முதலில் 1834 ஆம் ஆண்டில் அண்டோயின் செரோம் பலார்டு என்பவரால் தொகுப்பு முறையில் தயாரிக்கப்பட்டது.கேலூசக்குடன் இணைந்து இச்சேர்மத்தின் இயைபையும் இவர் உறுதி செய்தார். பண்டைக் காலத்தில் இச்சேர்மம் பெரும்பாலும் குளோரின் ஓராக்சைடு[2] என்றே அழைக்கப்பட்டது.தற்காலத்தைய நடுநிலை வகையான ClO சேர்மமும் குளோரின் ஓராக்சைடு என்றே அழைக்கப்படுவதால் குழப்பத்தினை தவிர்க்க இருகுளோரின் ஓராக்சைடு என்று அழைக்கப்படுகிறது.
 | |
 | |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
ஆக்சிசன் இருகுளோரைடு இருகுளோரின் ஆக்சைடு குளோரின்(I) ஆக்சைடு ஐப்போகுளோரசு ஆக்சைடு ஐப்போகுளோரசு நீரிலி | |
| இனங்காட்டிகள் | |
| 7791-21-1 | |
| ChEBI | CHEBI:30198 |
| ChemSpider | 23048 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24646 |
SMILES
| |
| பண்புகள் | |
| Cl2O | |
| வாய்ப்பாட்டு எடை | 86.9054 கி/மோல் |
| உருகுநிலை | |
| கொதிநிலை | 2.0 °C (35.6 °F; 275.1 K) |
| நன்றாகக் கரைகிறது, நீராற்பகுப்பு அடைகிறது 143 கி Cl2O 100 கி தண்ணீருக்கு | |
| other solvents-இல் கரைதிறன் | CCl4 இல் கரையும் |
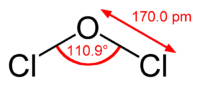
| கட்டமைப்பு | |
| இருமுனைத் திருப்புமை (Dipole moment) | 0.78 ± 0.08 D |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
+80.3 கி.யூ மோல்−1 |
| நியம மோலார் எந்திரோப்பி S |
265.9 யூ கெ−1 mol−1 |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | [1] |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய நேர் மின்அயனிகள் | நைட்ரசு ஆக்சைடு, இருபுரோமின் ஓராக்சைடு, தண்ணீர் |
| தொடர்புடைய சேர்மங்கள் | ஆக்சிசன் இருபுளோரைடு, குளோரின் ஈராக்சைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
அறை வெப்பநிலையில் இருகுளோரின் ஓராக்சைடு பழுப்பும் மஞ்சளும் கலந்த நிறமுடைய வாயுவாகவும் ,தண்ணீர் மற்றும் கரிமக் கரைப்பான்களில் கரையக்கூடிய தன்மையுடனும் காணப்படுகிறது. வேதியியல் முறையில் இது குளோரின் ஆக்சைடு தொகுதிச் சேர்மங்களின் ஒரு உறுப்பினராகும். மேலும், ஐப்போகுளோரசு அமிலத்தின் நீரிலி உப்பாகவும் விளங்குகிறது. வலிமையான ஆக்சிசனேற்றியான இச்சேர்மம் ஒரு சிறந்த குளோரினேற்றியாகவும் செயல்படுகிறது.
தயாரிப்பு
பாதரச(II) ஆக்சைடுடன் குளோரின்[2] வாயுவை வினைபுரியச்செய்து முற்காலத்தில் இருகுளோரின் ஓராக்சைடு தயாரிக்கப்பட்டது. எனினும் இம்முறை மிகுந்த பொருட்செலவும், பாதரசநச்சின் காரணமாக மிகவும் அபாயகரமான முறையாகவும் இருக்கிறது.
- 2 Cl2 + 2 HgO → HgCl2 + Cl2O
குளோரின் வாயுவுடன் நீரேற்றம் செய்யப்பட்ட சோடியம் கார்பனேட்டை 20 முதல் 30 0 செல்சியசு வெப்பநிலையில் வினைபுரியச் செய்து தயாரிக்கும் முறையே மிகவும் பாதுகாப்பான முறையாகும்.
- 2 Cl2 + 2 Na2CO3 + H2O → Cl2O + 2 NaHCO3 + 2 NaCl
- 2 Cl2 + 2 NaHCO3 → Cl2O + 2 CO2 + 2 NaCl + H2O
இவ்வினை தண்ணீரில்லாமல் ஆனால் 150 முதல் 250 0 செல்சியசு வெப்பநிலைக்கு சூடுபடுத்து போது நிகழ்கிறது. இவ்வெப்பநிலைக்கு மேல் இருகுளோரின் ஓராக்சைடு நிலைப்புத்தன்மையை இழந்து விடுவதால்[3] வெப்பச்சிதைவைத் தடுக்க தொடர்ச்சியாக இச்சேர்மம் வினையில் இருந்து நீக்கப்பட வேண்டும்.
- 2 Cl2 + Na2CO3 → Cl2O + CO2 + 2 NaCl
கால்சியம் ஐப்போகுளோரைட்டை, கார்பன் டை ஆக்சைடுடன் சேர்த்து வினைப்படுத்துவதன் மூலமும் இருகுளோரின் ஓராக்சைடைத் தயாரிக்கலாம்.
- Ca(ClO)2 + CO2 → CaCO3 + Cl2O
அமைப்பு
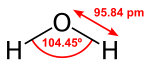
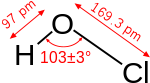
இருகுளோரின் ஓராக்சைடானது தண்ணீர் மற்றும் ஐப்போகுளோரசு அமிலம் அகியனவற்றின் மூலக்கூறு அமைப்பை ஏற்றுள்ளது.இந்த வளைவு மூலக்கூற்று வடிவமைப்பிற்கு ஆக்சிசன் மீதான தனித்த எலக்ட்ரான் இரட்டைகளே காரணமாகும். இதனால்C2V மூலக்கூற்று வடிவம் விளைகிறது. பெரிய குளோரின் அணுக்களுக்கு இடையிலான கொள்ளிட எதிர்ப்பு காரணத்தால் மூலக்கூறுகளுக்கு இடையேயான பிணைப்புக் கோணம் வழக்கத்தை விட அதிகமான அளவுகளில் காணப்படுகிறது.
திண்ம நிலையில் இச்சேர்மம் நான்முக இடக்குழு I41/amd வகையில் படிகமாகிறது. இப்படிகம் தண்ணீரின் அதிக அழுத்த வடிவமான பனிக்கட்டி VIII இன் சமவடிவமைப்பை உருவாக்குகிறது[4]
வினைகள்
இருகுளோரின் ஓராக்சைடு தண்ணீரில் மிகநன்றாக கரைகிறது[5]. கரைசலில் இது HOCl உடன் சமநிலை கொண்டுள்ளது. தேவையான அளவுக்கு நீராற்பகுப்பு நேரவீதம் மெதுவாக இருப்பதால் CCl4 போன்ற கரிமக் கரைப்பான்களில் இருந்து இருகுளோரின் ஓராக்சைடை பிரித்தெடுப்பது இயல்கிறது[2].ஆனால் சமநிலை மாறிலியின் மதிப்பு ஐப்போகுளோரசு அமிலம் உருவாவதற்கான வாய்ப்பை அளிக்கிறது [6]
- 2 HOCl ⇌ Cl2O + H2O K (0 °C) = 3.55x10−3 dm3/mol
இதைத் தவிர, ஒலிபீன் மற்றும் அரோமாட்டிக் சேர்மங்கள் [7][8] HOCl உடன் புரியும் வினையிலும், குடிநீரின் குளோரினேற்ற வினையிலும் இருகுளோரின் ஓராக்சைடு தீவிரமாகச் செயல்படுமெனவும் பரிந்துரைக்கப்படுகிறது.[9]
கனிமச் சேர்மங்களுடன் வினை
இருகுளோரின் ஓராக்சைடு உலோக ஆலைடுகளுடன் வினைபுரியும் போது Cl2,மூலக்கூறை இழந்து வழக்கத்திற்கு மாறாக ஆக்சி ஆலைடுகளை உருவாக்குகிறது..[2][10][11]
- VOCl3 + Cl2O → VO2Cl + 2 Cl2
- TiCl4 + Cl2O → TiOCI2 + 2 Cl2
- SbCI5 + 2 CI2O → SbO2CI + 4 Cl2
சிலவகை கனிம ஆலைடுகளிலும் இத்தைகய வினைகள் காணப்படுகின்றன.[12][13]
- AsCI3 + 2 CI2O → AsO2CI + 3 Cl2
- NOCl + Cl2O → NO2Cl + Cl2
கரிமச் சேர்மங்களுடன் வினை
இருகுளோரின் ஓராக்சைடு ஒரு பயனுள்ள குளோரினேற்றம் செய்யும் முகவராகச் செயல்படுகிறது. செயலிழக்கம் செய்யப்பட்ட அரோமாட்டிக் தளப்பொருட்களில்[14] பக்கச் சங்கிலியை உருவாக்க அல்லது வளைய குளோரினேற்றம் நிகழ்த்த இச்சேர்மம் பயன்படுத்தப்படுகிறது. பீனால் மற்றும் அரைல்-ஈதர்கள் போன்ற செயல் திறனூட்டிய அரோமாட்டிக் சேர்மங்களுடன் வினைபுரியும் போது முதலில் வளைய ஆலசனேற்றம் செய்யப்பட்ட பொருட்களைக் கொடுக்கிறது.[15]
ஒளி வேதியியல் வினை
ஓளிமின்பிரிகை அடைந்து இருகுளோரின் ஒராக்சைடு ஆக்சிசன் மற்றும் குளோரினாக உருவாகிறது. இச்செயல் முறையானது, முதன்மையாக பளிச்சொளி ஒளிப்பகுப்புடன் கூடிய தனி உறுப்பை அடிப்படையாகக் கொண்டது. (ClO•) தனியுறுப்பு இச்செயல் முறையில் ஒரு முக்கியமான இடைநிலையாகத் தோன்றுகிறது.[16]
- 2 Cl2O → 2 Cl2 + O2
வெடிக்கும் பண்புகள்
நவீன ஆராய்ச்சிகள் எதுவும் மேற்கொள்ளப்படாவிட்டாலும் இருகுளோரின் ஓராக்சைடு ஒரு வெடிபொருளாக இருக்கிறது. அறை வெப்பநிலையில் ஆக்சிசனுடன் கலக்கப்பட்டாலும் குறைந்த பட்சமாக 23.5% Cl2O இல்லாவிட்டால் Cl2O.[17] அந்தக் கலவை மின்பொறிகளால் வெடிப்பதில்லை. இதுவே அதிகபட்ச குறைந்த அளவு வெடிக்கும் எல்லை கொண்ட சேர்மமாகும். திடமான ஒளிக்கு[18][19] காட்சிப்படுத்தும் போது இதன் வெடிக்கும் தன்மை குறித்து முரண்பாடான கருத்துகள் தெரிவிக்கப்படுகின்றன. 120 0 செல்சியசு வெப்பநிலைக்கு மேல் இருகுளோரின் ஓராக்சைடை சூடுபடுத்தினாலும் அல்லது தாழ்ந்த வெப்பநிலைகளில் விரைவான வீதத்துடன் சூடுபடுத்தினாலும் வெடிக்கும் நிகழ்வுகள் நடக்கின்றன.[2]
திரவநிலை இருகுளோரின் ஓராக்சைடு அதிர்ச்சிகளுக்கு உணர்திறன் கொண்டிருப்பதாக அறிக்கைகள் தெரிவிக்கின்றன[20].
மேற்கோள்கள்
- "CHLORINE MONOXIDE". National Oceanic and Atmospheric Administration. பார்த்த நாள் 12 May 2015.
- Renard, J. J.; Bolker, H. I. (1 August 1976). "The chemistry of chlorine monoxide (dichlorine monoxide)". Chemical Reviews 76 (4): 487–508. doi:10.1021/cr60302a004.
- Hinshelwood, Cyril Norman; Prichard, Charles Ross (1923). "CCCXIII.—A homogeneous gas reaction. The thermal decomposition of chlorine monoxide. Part I". Journal of the Chemical Society, Transactions 123: 2730. doi:10.1039/CT9232302730.
- Minkwitz, R.; Bröchler, R.; Borrmann, H. (1 January 1998). "Tieftemperatur-Kristallstruktur von Dichlormonoxid, Cl2O". Zeitschrift für Kristallographie 213 (4): 237–239. doi:10.1524/zkri.1998.213.4.237.
- Davis, D. S. (1942). "Nomograph for the Solubility of Chlorine Monoxide in Water". Industrial & Engineering Chemistry 34 (5): 624–624. doi:10.1021/ie50389a021.
- Aylett, founded by A.F. Holleman ; continued by Egon Wiberg ; translated by Mary Eagleson, William Brewer ; revised by Bernhard J. (2001). Inorganic chemistry (1st English ed., [edited] by Nils Wiberg. ). San Diego, Calif. : Berlin: Academic Press, W. de Gruyter.. பக். 442. பன்னாட்டுத் தரப்புத்தக எண்:9780123526519.
- Swain, C. Gardner; Crist, DeLanson R. (1 May 1972). "Mechanisms of chlorination by hypochlorous acid. The last of chlorinium ion, Cl+". Journal of the American Chemical Society 94 (9): 3195–3200. doi:10.1021/ja00764a050.
- Sivey, John D.; McCullough, Corey E.; Roberts, A. Lynn (1 May 2010). "Chlorine Monoxide (Cl2O) and Molecular Chlorine (Cl2) as Active Chlorinating Agents in Reaction of Dimethenamid with Aqueous Free Chlorine". Environmental Science & Technology 44 (9): 3357–3362. doi:10.1021/es9038903.
- Powell, Steven C. (1 May 2010). "The active species in drinking water chlorination: the case for Cl2O". Environmental Science & Technology 44 (9): 3203–3203. doi:10.1021/es100800t.
- Oppermann, H. (1967). "Untersuchungen an Vanadinoxidchloriden und Vanadinchloriden. I. Gleichgewichte mit VOCl3, VO2Cl und VOCl2". Zeitschrift für anorganische und allgemeine Chemie 351 (3-4): 113–126. doi:10.1002/zaac.19673510302.
- Dehnicke, Kurt (1961). "Titan(IV)-Oxidchlorid TiOCl2". Zeitschrift für anorganische und allgemeine Chemie 309 (5-6): 266–275. doi:10.1002/zaac.19613090505.
- Dehnicke, Kurt (1 December 1964). "Über die Oxidchloride PO2Cl, AsO2Cl und SbO2Cl". Chemische Berichte 97 (12): 3358–3362. doi:10.1002/cber.19640971215.
- Martin, H. (1 January 1966). "Kinetic Relationships between Reactions in the Gas Phase and in Solution". Angewandte Chemie International Edition in English 5 (1): 78–84. doi:10.1002/anie.196600781.
- Marsh, F. D.; Farnham, W. B.; Sam, D. J.; Smart, B. E. (1 August 1982). "Dichlorine monoxide: a powerful and selective chlorinating reagent". Journal of the American Chemical Society 104 (17): 4680–4682. doi:10.1021/ja00381a032.
- Sivey, John D.; Roberts, A. Lynn (21 February 2012). "Assessing the Assessing the Reactivity of Free Chlorine Constituents Cl2, Cl2O, and HOCl Toward Aromatic Ethers". Environmental Science & Technology 46 (4): 2141–2147. doi:10.1021/es203094z.
- Basco, N.; Dogra, S. K. (22 June 1971). "Reactions of Halogen Oxides Studied by Flash Photolysis. II. The Flash Photolysis of Chlorine Monoxide and of the ClO Free Radical". Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences 323 (1554): 401–415. doi:10.1098/rspa.1971.0112.
- Cady, George H.; Brown, Robert E. (September 1945). "Minimum Explosive Concentration of Chlorine Monoxide Diluted with Oxygen". Journal of the American Chemical Society 67 (9): 1614–1615. doi:10.1021/ja01225a501.
- Iredale, T.; Edwards, T. G. (April 1937). "Photoreaction of Chlorine Monoxide and Hydrogen". Journal of the American Chemical Society 59 (4): 761–761. doi:10.1021/ja01283a504.
- Wallace, Janet I.; Goodeve, C. F. (1 January 1931). "The heats of dissociation of chlorine monoxide and chlorine dioxide". Transactions of the Faraday Society 27: 648. doi:10.1039/TF9312700648.
- Pilipovich, Donald.; Lindahl, C. B.; Schack, Carl J.; Wilson, R. D.; Christe, Karl O. (1972). "Chlorine trifluoride oxide. I. Preparation and properties". Inorganic Chemistry 11 (9): 2189–2192. doi:10.1021/ic50115a040.
| குளோரைடுகள் | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HCl | He | ||||||||||||||||||
| LiCl | BeCl2 | BCl3 B2Cl4 |
CCl4 | NCl3 ClN3 |
Cl2O ClO2 Cl2O7 |
ClF ClF3 ClF5 |
Ne | ||||||||||||
| NaCl | MgCl2 | AlCl AlCl3 |
SiCl4 | P2Cl4 PCl3 PCl5 |
S2Cl2 SCl2 SCl4 |
Cl2 | Ar | ||||||||||||
| KCl | CaCl CaCl2 |
ScCl3 | TiCl2 TiCl3 TiCl4 |
VCl2 VCl3 VCl4 VCl5 |
CrCl2 CrCl3 CrCl4 |
MnCl2 | FeCl2 FeCl3 |
CoCl2 CoCl3 |
NiCl2 | CuCl CuCl2 |
ZnCl2 | GaCl2 GaCl3 |
GeCl2 GeCl4 |
AsCl3 AsCl5 |
Se2Cl2 SeCl4 |
BrCl | KrCl | ||
| RbCl | SrCl2 | YCl3 | ZrCl3 ZrCl4 |
NbCl4 NbCl5 |
MoCl2 MoCl3 MoCl4 MoCl5 MoCl6 |
TcCl4 | RuCl3 | RhCl3 | PdCl2 | AgCl | CdCl2 | InCl InCl2 InCl3 |
SnCl2 SnCl4 |
SbCl3 SbCl5 |
Te3Cl2 TeCl4 |
ICl ICl3 |
XeCl XeCl2 | ||
| CsCl | BaCl2 | HfCl4 | TaCl5 | WCl2 WCl3 WCl4 WCl5 WCl6 |
Re3Cl9 ReCl4 ReCl5 ReCl6 |
OsCl4 | IrCl2 IrCl3 IrCl4 |
PtCl2 PtCl4 |
AuCl AuCl3 |
Hg2Cl2, HgCl2 |
TlCl | PbCl2, PbCl4 |
BiCl3 | PoCl2, PoCl4 |
AtCl | RnCl2 | |||
| FrCl | RaCl2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| LaCl3 | CeCl3 | PrCl3 | NdCl2, NdCl3 |
PmCl3 | SmCl2, SmCl3 |
EuCl2, EuCl3 |
GdCl3 | TbCl3 | DyCl2, DyCl3 |
HoCl3 | ErCl3 | TmCl2 TmCl3 |
YbCl2 YbCl3 |
LuCl3 | |||||
| AcCl3 | ThCl4 | PaCl5 | UCl3 UCl4 UCl5 UCl6 |
NpCl4 | PuCl3 | AmCl2 AmCl3 |
CmCl3 | BkCl3 | CfCl3 | EsCl3 | Fm | Md | No | LrCl3 | |||||