சீரியம்(III) குளோரைடு
சீரியம்(III) குளோரைடு (Cerium(III) chloride) என்பது CeCl3 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். சீரியம் மற்றும் குளோரின் சேர்ந்து உருவாகும் இச்சேர்மம் சீரசு குளோரைடு அல்லது சீரியம் முக்குளோரைடு என்றும் அழைக்கப்படுகிறது. நீருறிஞ்சும் தன்மை கொண்டுள்ள சீரியம்(III) குளோரைடு வெண்மை நிறத் திண்மமாக காணப்படுகிறது. சுற்றுச்சூழலில் உள்ள ஈரக்காற்றை உறிஞ்சி விரைவாக நீரேற்றாக மாறுகிறது. CeCl3•7 H2O என்ற அறியப்பட்டுள்ள இந்நீரேற்றில் பல பகுதிப்பொருட்கள் கலந்திருக்கின்றன[1]. எழுநீரேற்று என்றழைக்கப்படும் இச்சேர்மம் தண்ணீரில் கரையக்கூடியதாக உள்ளது. நிரிலியாக உள்ளபோது இது எத்தனால் மற்றும் அசிட்டோனில்[2] கரைகிறது.
 | |||
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்s
சீரியம்(III) குளோரைடு சீரியம் முக்குளோரைடு | |||
| வேறு பெயர்கள்
சீரசு குளோரைடு | |||
| இனங்காட்டிகள் | |||
| 7790-86-5 18618-55-8 (எழுநீரேற்று) | |||
| ChEBI | CHEBI:35458 | ||
| ChemSpider | 23038 | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 24636 | ||
SMILES
| |||
| UNII | TH8E3IE00V | ||
| பண்புகள் | |||
| CeCl3 | |||
| வாய்ப்பாட்டு எடை | 246.48 கி/மோல் (நீரிலி) 372.58 கி/மோல் (எழுநீரேற்று) | ||
| தோற்றம் | வெண்மையான தூள் | ||
| அடர்த்தி | 3.97 கி/செ,மீ3 | ||
| உருகுநிலை | |||
| கொதிநிலை | 1,727 °C (3,141 °F; 2,000 K) | ||
| 100 கி/100 மி.லி | |||
| கரைதிறன் | ஆல்ககாலில் கரையும் | ||
| கட்டமைப்பு | |||
| படிக அமைப்பு | hexagonal (UCl3 type), hP8 | ||
| புறவெளித் தொகுதி | P63/m, No. 176 | ||
| ஒருங்கிணைவு வடிவியல் |
மூவுச்சி முக்கோணப் பட்டகம் (ஒன்பது ஒருங்கிணைவுகள்) | ||
| தீங்குகள் | |||
| ஈயூ வகைப்பாடு | பட்டியலிடப்படவில்லை | ||
| தீப்பற்றும் வெப்பநிலை | எளிதில் தீப்பற்றாது | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | சீரியம்(III) ஆக்சைடு சீரியம்(III) புளோரைடு சீரியம்(III) புரோமைடு சீரியம்(III) அயோடைடு | ||
| ஏனைய நேர் மின்அயனிகள் | இலந்தனம்(III) குளோரைடு பிரசியோடிமியம்(III) குளோரைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
நீரிலி வகை சீரியம்(III) குளோரைடு தயாரித்தல்
நீரேற்றுகளை எளிய வெப்பப்படுத்தல் வினைக்கு மட்டும் உட்படுத்தினால் நீராற்பகுத்தல் மூலம் மிகக் குறைவான அளவு சீரியம்(III) குளோரைடே கிடைக்கிறது[3]. நீரிலி வகை சீரியம்(III) குளோரைடு தயாரிக்க வேண்டுமெனில் சீரியம்எழுநீரேற்றை படிப்படியாக வெற்றிடத்தில் 140 பாகை செல்சியசு வெப்பநிலைக்கு பல மணி நேரங்கள் சூடுபடுத்த வேண்டும்[2][4][5]. அவ்வாறு சூடாக்கும் போது நீராற்பகுப்பின் மூலமாக CeOCl சிறிதளவு உருவாவதற்கான வாய்ப்புகள் உண்டு. ஆனாலும், கரிம இலித்தியம் அல்லது கிரிக்னார்டு காரணியுடன் வினைபுரியத் தேவையான வினைபொருள் தயாரிக்க இம்முறையே சிறந்ததாக கருதப்படுகிறது.
எழுநீரேற்றை 4-6 பங்கு அமோனியம் குளோரைடு சேர்த்து உயர் வெற்றிடத்தில் 400 பாகை செல்சியசு வெப்பநிலைக்கு சிறிது சிறிதாக சூடுபடுத்தி ஐதரசன் நீக்கம் செய்வதன் மூலம் [3][6][7][8] அல்லது அதிமான அளவு தயோனைல் குளோரைடு எனப்படும் கந்தகக் குளோரைடுடன் சேர்த்து மூன்று மணி நேரத்திற்கு சூடுபடுத்துவதன் மூலம் தூய்மையான நீரிலி வகை சீரியம்(III) குளோரைடு தயாரிக்க முடியும்.[3][9] மாறாக ஐதரசன் குளோரைடுடன் சீரியம் உலோகத்தைச் சேர்த்து வினைபுரியச் செய்தும் நீரற்ற இந்த ஆலைடை தயாரித்துக் கொள்ள முடியும்[10][11].இவ்வாறு தயாரிக்கப்படும் சீரியம் முக்குளோரைடு உயர் வெற்றிடத்தில் உயர் வெப்பநிலை பதங்கமாதல் வினையின் மூலம் தூய்மைப்படுத்தப்படுகிறது.
பயன்கள்
பிரைடல் கிராப்ட் அசைலேற்ற வினைகளில் பயனாகும் இலூயிக் அமிலம், சீரியம்(III) முப்புளோரோமெத்தேன்சல்போனேட்டு போன்ற பல்வேறு சீரியம் உப்புகளை தயாரிப்பதற்கு தேவையான தொடக்கப் பொருளாக சீரியம்(III) குளோரைடு பயன்படுகிறது. வினையூக்கியான சீரியம்(III) குளோரைடு , பிரைடல் கிராப்ட் அல்கைலேற்ற வினையில் தானே ஒரு இலூயிக் அமிலமாகச் செயல்படுகிறது.[12]
லுச்செ ஒடுக்கம்
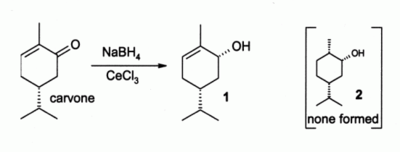
ஆல்பா, பீட்டா – நிறைவுறா கார்பனைல் சேர்மங்களை லுச்செ ஒடுக்க [13] வினைக்கு உட்படுத்தும் கரிமத் தொகுப்பு வினைகள் தற்காலத்தில் அனைவரது கவனத்தையும் ஈர்க்கும் தயாரிப்பு முறையாக அறியப்படுகிறது. இவ்வினையில் சீரியம் எழுநீரேற்றுடன் இணைப்பாக சோடியம் போரோஐதரேட்டு பயன்படுகிறது. உதாரணமாக, கார்வோன் நிறைவுற்ற ஆல்ககால் 2 வைத் தராமல் , அல்லைலிக் ஆல்ககாகாலை மட்டுமே தருகிறது சீரியம்(III) குளோரைடு இல்லாத வினையெனில் இவ்விரண்டு சேர்மங்களின் கலவை உருவாகிறது.
கீட்டோன்களை அல்கைலேற்றம் செய்யும் வினை மற்றொரு முக்கியமான பயனாகும். எளிய கரிம இலித்தியம் சேர்மங்களைப் பயன்படுத்தினால் இவ்வினையில் இனோலேட்டுகள் மட்டுமே உருவாகும். உதாரணமாக CeCl3 இல்லாமல் ஈனோலேட்டைலிருந்து 3 என எண்ணிடப்பட்ட சேர்மம் உருவாகலாம் என எதிர்பார்க்கப்படுகிறது. ஆனால் CeCl3 இடம்பெற்றிருக்கும் வினைகளில் இயல்பான அல்கைலேற்ற வினை நிகழ்கிறது.:[4]
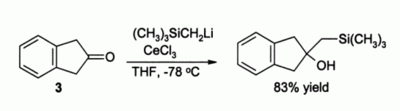
இவ்வினையில் கரிம இலித்தியம் வினைப்பொருள் கிரிக்னார்டு வினைப்பொருளை விட நன்றாக பயனளிப்பதாக அறியப்படுகிறது.[4]
மேற்கோள்கள்
- Several major manufacturers such as Alfa and Strem list their products simply as a "hydrate" with "xH2O" in the formula, but Aldrich sells a heptahydrate.
- Paquette, L. A. (1999). Coates, R. M.; Denmark, S. E. (eds.). ed. Handbook of Reagents for Organic Synthesis: Reagents, Auxiliaries and Catalysts for C-C Bond Formation. New York: Wiley. பன்னாட்டுத் தரப்புத்தக எண்:0-471-97924-4.
- Edelmann, F. T.; Poremba, P. (1997). Herrmann, W. A. (ed.). ed. Synthetic Methods of Organometallic and Inorganic Chemistry. VI. Stuttgart: Georg Thieme Verlag. பன்னாட்டுத் தரப்புத்தக எண்:3-13-103021-6.
- Johnson, C. R.; Tait, B. D. (1987). "A cerium(III) modification of the Peterson reaction: methylenation of readily enolizable carbonyl compounds". Journal of Organic Chemistry 52 (2): 281–283. doi:10.1021/jo00378a024. பன்னாட்டுத் தர தொடர் எண்:0022-3263.
- Dimitrov, Vladimir; Kostova, Kalina; Genov, Miroslav (1996). "Anhydrous cerium(III) chloride — Effect of the drying process on activity and efficiency". Tetrahedron Letters 37 (37): 6787–6790. doi:10.1016/S0040-4039(96)01479-7.
- Taylor, M. D.; Carter, P. C. (1962). "Preparation of anhydrous lanthanide halides, especially iodides". Journal of Inorganic and Nuclear Chemistry 24 (4): 387–391. doi:10.1016/0022-1902(62)80034-7.
- Kutscher, J.; Schneider, A. (1971). "Notiz zur Präparation von wasserfreien Lanthaniden-Haloge-niden, Insbesondere von Jodiden". Inorg. Nucl. Chem. Lett. 7 (9): 815. doi:10.1016/0020-1650(71)80253-2.
- Greenwood, N. N.; Earnshaw, A. (1984). Chemistry of the Elements. New York: Pergamon Press. பன்னாட்டுத் தரப்புத்தக எண்:0-08-022056-8.
- Freeman, J. H.; Smith, M. L. (1958). "The preparation of anhydrous inorganic chlorides by dehydration with thionyl chloride". Journal of Inorganic and Nuclear Chemistry 7 (3): 224–227. doi:10.1016/0022-1902(58)80073-1.
- Druding, L. F.; Corbett, J. D. (1961). "Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide". Journal of the American Chemical Society 83 (11): 2462–2467. doi:10.1021/ja01472a010. பன்னாட்டுத் தர தொடர் எண்:00027863.
- Corbett, J. D. (1973). Rev. Chim. Minerale 10: 239.
- Mine, Norioki; Fujiwara, Yuzo; Taniguchi, Hiroshi (1986). "Trichlorolanthanoid (LnCl3)-catalyzed Friedel-Crafts alkylation reactions". Chemistry Letters 15 (3): 357–360. doi:10.1246/cl.1986.357.
- Luche, Jean-Louis; Rodriguez-Hahn, Lydia; Crabbé, Pierre (1978). "Reduction of natural enones in the presence of cerium trichloride". Journal of the Chemical Society, Chemical Communications (14): 601–602. doi:10.1039/C39780000601.
புற இணைப்புகள்
- CRC Handbook of Chemistry and Physics (58th edition), CRC Press, West Palm Beach, Florida, 1977.
- Anwander, R. (1999). Kobayashi, S. (ed.). ed. Lanthanides: Chemistry and Use in Organic Synthesis. Berlin: Springer-Verlag. பக். 10–12.
| குளோரைடுகள் | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HCl | He | ||||||||||||||||||
| LiCl | BeCl2 | BCl3 B2Cl4 |
CCl4 | NCl3 ClN3 |
Cl2O ClO2 Cl2O7 |
ClF ClF3 ClF5 |
Ne | ||||||||||||
| NaCl | MgCl2 | AlCl AlCl3 |
SiCl4 | P2Cl4 PCl3 PCl5 |
S2Cl2 SCl2 SCl4 |
Cl2 | Ar | ||||||||||||
| KCl | CaCl CaCl2 |
ScCl3 | TiCl2 TiCl3 TiCl4 |
VCl2 VCl3 VCl4 VCl5 |
CrCl2 CrCl3 CrCl4 |
MnCl2 | FeCl2 FeCl3 |
CoCl2 CoCl3 |
NiCl2 | CuCl CuCl2 |
ZnCl2 | GaCl2 GaCl3 |
GeCl2 GeCl4 |
AsCl3 AsCl5 |
Se2Cl2 SeCl4 |
BrCl | KrCl | ||
| RbCl | SrCl2 | YCl3 | ZrCl3 ZrCl4 |
NbCl4 NbCl5 |
MoCl2 MoCl3 MoCl4 MoCl5 MoCl6 |
TcCl4 | RuCl3 | RhCl3 | PdCl2 | AgCl | CdCl2 | InCl InCl2 InCl3 |
SnCl2 SnCl4 |
SbCl3 SbCl5 |
Te3Cl2 TeCl4 |
ICl ICl3 |
XeCl XeCl2 | ||
| CsCl | BaCl2 | HfCl4 | TaCl5 | WCl2 WCl3 WCl4 WCl5 WCl6 |
Re3Cl9 ReCl4 ReCl5 ReCl6 |
OsCl4 | IrCl2 IrCl3 IrCl4 |
PtCl2 PtCl4 |
AuCl AuCl3 |
Hg2Cl2, HgCl2 |
TlCl | PbCl2, PbCl4 |
BiCl3 | PoCl2, PoCl4 |
AtCl | RnCl2 | |||
| FrCl | RaCl2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| LaCl3 | CeCl3 | PrCl3 | NdCl2, NdCl3 |
PmCl3 | SmCl2, SmCl3 |
EuCl2, EuCl3 |
GdCl3 | TbCl3 | DyCl2, DyCl3 |
HoCl3 | ErCl3 | TmCl2 TmCl3 |
YbCl2 YbCl3 |
LuCl3 | |||||
| AcCl3 | ThCl4 | PaCl5 | UCl3 UCl4 UCl5 UCl6 |
NpCl4 | PuCl3 | AmCl2 AmCl3 |
CmCl3 | BkCl3 | CfCl3 | EsCl3 | Fm | Md | No | LrCl3 | |||||
_2.png)