நைட்ரசன் முக்குளோரைடு
நைட்ரசன் முக்குளோரைடு (Nitrogen trichloride), முக்குளோரமீன் எனவும் அழைக்கப்படுகிற, NCl3 என்ற மூலக்கூற்று வாய்ப்பாட்டை உடைய ஒரு வேதிச்சேர்மம் ஆகும். இந்த மஞ்சள் நிற, எண்ணெய் போன்ற, மூக்கைத் துளைக்கும் நெடியையுடைய, வெடிக்கும் தன்மையுடைய திரவமானது பெரும்பாலும் அம்மோனிய வழிப்பொருட்கள் மற்றும் குளோரின் ஆகியவற்றுக்கிடையே நடக்கும் வேதி வினைகளில் உப விளைபொருளாகக் கிடைக்கும் சேர்மமாகும்.
| |||
| பெயர்கள் | |||
|---|---|---|---|
| வேறு பெயர்கள்
முக்குளோரமீன் அஜீன் நைட்ரசன்(III) குளோரைடு முக்குளோரோஅசேன் முக்குளோரின் நைட்ரைடு | |||
| இனங்காட்டிகள் | |||
| 10025-85-1 | |||
| ChEBI | CHEBI:37382 | ||
| ChemSpider | 55361 | ||
| EC number | 233-045-1 | ||
Gmelin Reference |
1840 | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 61437 | ||
| வே.ந.வி.ப எண் | QW974000 | ||
SMILES
| |||
| UNII | VA681HRW8W | ||
| பண்புகள் | |||
| NCl3 | |||
| தோற்றம் | மஞ்சள் நிற எண்ணெய் போன்ற திரவம் | ||
| மணம் | குளோரினையொத்த மணம் | ||
| அடர்த்தி | 1.653 கி/மிலி | ||
| உருகுநிலை | |||
| கொதிநிலை | 71 °C (160 °F; 344 K) | ||
| கலக்கும் தன்மையற்றது மெதுவாகச் சிதைகிறது | |||
| கரைதிறன் | பென்சீனில் கரைகிறது, குளோரோபார்ம், CCl4, CS2, PCl3 | ||
| கட்டமைப்பு | |||
| படிக அமைப்பு | செஞ்சாய்சதுரம் ( −40 °செல்சியசிற்கும் கீழானது) | ||
| மூலக்கூறு வடிவம் | |||
| இருமுனைத் திருப்புமை (Dipole moment) | 0.6 D | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
232 கிலோயூல்/மோல் | ||
| தீங்குகள் | |||
| ஈயூ வகைப்பாடு | not listed | ||
Autoignition temperature |
93 °C (199 °F; 366 K) | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | நைட்ரசன் முப்புளோரைடு நைட்ரசன் முப்புரோமைடு நைட்ரசன் மூஅயோடைடு | ||
| ஏனைய நேர் மின்அயனிகள் | பாசுபரசு முக்குளோரைடு ஆர்செனிக் முக்குளோரைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
தயாரிப்பு மற்றும் அமைப்பு
இச்சேர்மமானது அம்மோனியம் நைட்ரேட்டு போன்ற அம்மோனியம் உப்புக்களை குளோரினுடன் வினைப்படுத்தி தயாரிக்கப்படுகிறது.
இந்த மாற்றத்தின் இடையில் கிடைக்கும் இடைநிலை வினைப்பாருட்கள் குளோரமீன் மற்றும் டைகுளோரமீன், முறையே NH2Cl மற்றும் NHCl2,ஆகியவற்றை உள்ளடக்கியதாகும்.
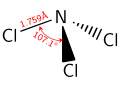
அம்மோனியாவைப் போல, NCl3 யும் ஒரு பிரமிடு அமைப்புடைய மூலக்கூறாகும். N-Cl பிணைப்பு நீளமானது 1.76 Å ஆகவும் Cl-N-Cl பிணைப்புக் கோணம் 107° ஆகவும் உள்ளது..[1]
வேதிவினைகள் மற்றும் பயன்கள்
NCl3 சேர்மத்தின் வேதியியலானது நன்கறியப்பட்டதாகும்.[2] இச்சேர்மம் மிதமான அளவு முனைவுத்தன்மை கொண்ட மூலக்கூறாகும். இதன் இருமுனைதிருப்புத்திறன் 0.6 டிபை ஆகும். நைட்ரஜன் மையமானது காரத்தன்மையுடையது. ஆனால் இதன் காரத்தன்மை அம்மோனியாவுடன் ஒப்பிடும் போது மிகக்குறைவானது. இச்சேர்மம் சூடான நீருடன் வினைப்படுத்தும் போது நீராற்பகுக்கப்பட்டு அம்மோனியா மற்றும் ஹைப்போகுளோரசு அமிலம் ஆகியவற்றைத் தருகிறது.
- NCl3 + 3 H2O → NH3 + 3 HOCl
NCl3 வெடித்துச் சிதைந்து நைட்ரசன் (N2) மற்றும் குளோரின் வாயு ஆகியவற்றைத் தருகிறது. and chlorine gas. இந்த வினையானது வீரியம் குறைந்த வாயுக்களில் தடுக்கப்படுகிறது.
பொது குடிநீர் வழங்கலின் போது மோனோகுளோரமீன் போன்றவற்றால் அசுத்தமாக்கப்படும் போதும், நீச்சல் குளங்களில் குளோரினானது குளிப்பவர்களின் சிறுநீர் மற்றும் வியர்வையால் அசுத்தமாக்கப்படும் போதும் சிறிய அளவில் நைட்ரசன் முக்குளோரைடு உருவாகும் வாய்ப்பு உள்ளது,
நைட்ரசன் முக்குளோரைடானது, அஜீன் என்ற வணிகப்பெயர் சூட்டப்பட்டு முந்தைய காலத்தில் மாவினை வெண்மையாக்கப் பயன்படுத்தப்பட்டது.[3] ஆனால், 1949 ஆம் ஆண்டில் பாதுகாப்புக் காரணங்களுக்காக இந்த நடைமுறையானது அமெரிக்க ஐக்கிய நாடுகளில் தடை செய்யப்பட்டது.
பாதுகாப்பு
நைட்ரசன் முக்குளோரைடு சீதச்சவ்வில் எரிச்சலை ஏற்படுத்தலாம்.—மேலும், இது கண்ணீரை சுரக்கச் செய்யும் காரணியாகும், ஆனால் இச்சேர்மம் ஒருபோதும் அவ்வாறு பயன்படுத்தப்பட்டதில்லை.[4][5] இச்சேர்மத்தின் தூய்மையான வடிவம் மிக ஆபத்தான வெடிக்கும் தன்மை கொண்டது. இச்சேர்மம், ஒளி, வெப்பம், மிதமான அதிர்வுகள் மற்றும் கரிமச் சேர்மங்கள் ஆகியவற்றுக்கு நுண்ணுணர்வு கொண்டதாகும். 1812 ஆம் ஆண்டில், பியரி லூயிசு டூலாங் இச்சேர்மத்தைப் பிரித்தெடுத்தார். இச்செயல்முறையின் போது நிகழ்ந்த இரண்டு வெடிவிபத்துகளின் காரணமாக தனது இரண்டு விரல்கள் மற்றும் ஒரு கண் ஆகியவற்றை இழந்தார்.[6]1813 ஆம் ஆண்டில், NCl3 வெடிப்பின் காரணமாக சர் அம்ப்ரி டேவி தற்காலிகமாக பார்வையை இழந்தார். பிறகு மைக்கேல் பாரடேயை தன்னுடன் இணை ஆய்வாளராக சேர்த்துக் கொண்டார். இதற்குப் பிறகு மிகக் குறுகிய காலத்திலேயே நடந்த மற்றொரு NCl3 வெடித்தலின் போது இருவருமே காயமைடந்தனர்.[7]
மேற்கோள்கள்
- Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. பன்னாட்டுத் தரப்புத்தக எண்:978-0-12-352651-9.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth–Heinemann. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- Hawthorn, J.; Todd, J. P. (1955). "Some effects of oxygen on the mixing of bread doughs". Journal of the Science of Food and Agriculture 6 (9): 501–511. doi:10.1002/jsfa.2740060906.
- White, G. C. (1999). The Handbook of Chlorination and Alternative Disinfectants (4th ). Wiley. பக். 322. பன்னாட்டுத் தரப்புத்தக எண்:978-0-471-29207-4.
- "Health Hazard Evaluation Report: Investigation of Employee Symptoms at an Indoor Water Park" (pdf). NIOSH ENews 6 (4). August 2008. HETA 2007-0163-3062. https://www.cdc.gov/niosh/hhe/reports/pdfs/2007-0163-3062.pdf.
- Thénard J. L.; Claude Louis Berthollet (1813). "Report on the work of Pierre Louis Dulong". Annales de Chimie et de Physique 86 (6): 37–43.
- Thomas, J.M. (1991). Michael Faraday and The Royal Institution: The Genius of Man and Place (PBK). CRC Press. பக். 17. பன்னாட்டுத் தரப்புத்தக எண்:978-0-7503-0145-9. https://books.google.com/books?id=GN70U1tTe_EC&pg=PA17.