இட்ரியம்(III) குளோரைடு
இட்ரியம்(III) குளோரைடு (Yttrium(III) chloride) என்பது YCl3 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். இட்ரியம் மற்றும் குளோரின் சேர்ந்து உருவாகும் இச்சேர்மம் நீரிலி (YCl3) மற்றும் நீரேற்று (YCl3(H2O)6) ஆகிய இரண்டு வடிவங்களில் காணப்படுகிறது. இரண்டுமே நிறமற்ற திண்மங்களாக தண்ணீரில் நன்றாக கரைந்து நீர்மயமாகின்றன.
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்s
இட்ரியம்(III) குளோரைடு இட்ரியம் முக்குளோரைடு | |
| இனங்காட்டிகள் | |
| 10361-92-9 | |
| ChemSpider | 59696 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| வே.ந.வி.ப எண் | ZG3150000 |
SMILES
| |
| பண்புகள் | |
| YCl3 | |
| வாய்ப்பாட்டு எடை | 195.26 g/mol |
| தோற்றம் | வெண் திண்மம் |
| அடர்த்தி | 2.67 கி/செ.மீ3 |
| உருகுநிலை | |
| கொதிநிலை | 1,507 °C (2,745 °F; 1,780 K) |
| 82 கி/100 மி.லி | |
| கரைதிறன் | 60.1 கி/100 மி.லி எத்தனால் (15 °செ) 60.6 கி/100 மி.லி பிரிடின் (15 °செ)[1] |
| கட்டமைப்பு | |
| படிக அமைப்பு | ஒற்றைச்சரிவு, mS16 |
| புறவெளித் தொகுதி | C12/m1, No. 12 |
| தீங்குகள் | |
| தீப்பற்றும் வெப்பநிலை | எளிதில் தீப்பற்றாது |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | இட்ரியம்(III) புளோரைடு இட்ரியம்(III) புரோமைடு இட்ரியம்(III) அயோடைடு |
| ஏனைய நேர் மின்அயனிகள் | இசுக்காண்டியம்(III) குளோரைடு இலந்தனம்(III) குளோரைடு ஆக்டினியம்(III) குளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
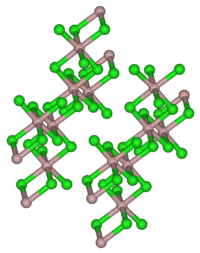
அமைப்பு
திண்மநிலை YCl3 , குளோரைடு அயனிகளின் கனசதுர நெருக்கப் பொதிவு கட்டமைப்பை ஏற்றுள்ளது. இட்ரியம் அயனிகள் எண்முகத் துளைகளின் மூன்றில் ஒரு பங்கு பொதிவை நிரப்புகின்றன. விளைகின்ற YCl6 அடுத்தடுத்த எண்முகத்தின் முனைகளை பகிர்ந்து கொண்டு அடுக்குக் கட்டமைப்பைத் தருகிறது[2] This structure is shared by a range of compounds notably AlCl3.
.இந்தக் கட்டமைப்பு பெரும்பாலான சேர்மங்களால் , குறிப்பாக AlCl3 சேர்மத்தால் பகிர்ந்து கொள்ளப்படுகிறது.
தயாரிப்பு மற்றும் வினைகள்
பெரும்பாலும் அமோனியம் குளோரைடு வழியாகத்தான் YCl3 தயாரிக்கப்படுகிறது. இவ்வினையின் தொடக்கம் Y2O3 அல்லது நீரேற்ற குளோரைடு அல்லது ஆக்சிகுளோரைடு [3][4] அல்லது YCl3•6H2O. இவற்றில் ஒன்றிடமிருந்துதான் தொடங்குகிறது. இம்முறைகளில் (NH4)2[YCl5]:சேர்மம் தயாரிக்கப்படுகிறது.
- 10 NH4Cl + Y2O3 → 2 (NH4)2[YCl5] + 6 NH3 + 3 H2O
- YCl3·6H2O + 2 NH4Cl → (NH4)2[YCl5] + 6 H2O
இப்பென்டாகுளோரைடு வெப்பத்தால் பின்வருமாறு சிதைவடைகிறது.இவ்வெப்ப முறிவு வினை (NH4)[Y2Cl7]என்ற இடைநிலையின் வழியாக மேலும் தொடர்கிறது.
- (NH4)2[YCl5] → 2 NH4Cl + YCl3
Y2O3 உடன் நீர்க்கரைசலான HCl சேர்த்து வினைப்படுத்தினால் நீரேற்ற குளோரைடை YCl3· 6H2O உற்பத்தி செய்கிறது.[5] இவ்வுப்பைச் சூடுபடுத்தினால் இது நீரிலியைக் கொடுப்பதில்லை, மாறாக ஓர் ஆக்சி குளோரைடைக் கொடுக்கிறது.(NH4)2[YCl5]:
மேற்கோள்கள்
- Spencer, James F. (1919), The Metals of the Rare Earths, New York: Longmans, Green, and Co, pp. 135, http://books.google.com/?id=W2zxN_FLQm8C&pg=PA135, பார்த்த நாள்: 2008-05-29
- Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- Meyer, G. (1989). "The Ammonium Chloride Route to Anhydrous Rare Earth Chlorides-The Example of YCl3". Inorganic Syntheses 25: 146–150. doi:10.1002/9780470132562.ch35. பன்னாட்டுத் தரப்புத்தக எண்:978-0-470-13256-2.
- Edelmann, F. T.; Poremba, P. (1997). Herrmann, W. A. (ed.). ed. Synthetic Methods of Organometallic and Inorganic Chemistry. VI. Stuttgart: Georg Thieme Verlag. பன்னாட்டுத் தரப்புத்தக எண்:3-13-103021-6.
- Taylor, M.D.; Carter, C.P.. "Preparation of anhydrous lanthanide halides, especially iodides". Journal of Inorganic and Nuclear Chemistry 24 (4): 387–391. doi:10.1016/0022-1902(62)80034-7.
| குளோரைடுகள் | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HCl | He | ||||||||||||||||||
| LiCl | BeCl2 | BCl3 B2Cl4 |
CCl4 | NCl3 ClN3 |
Cl2O ClO2 Cl2O7 |
ClF ClF3 ClF5 |
Ne | ||||||||||||
| NaCl | MgCl2 | AlCl AlCl3 |
SiCl4 | P2Cl4 PCl3 PCl5 |
S2Cl2 SCl2 SCl4 |
Cl2 | Ar | ||||||||||||
| KCl | CaCl CaCl2 |
ScCl3 | TiCl2 TiCl3 TiCl4 |
VCl2 VCl3 VCl4 VCl5 |
CrCl2 CrCl3 CrCl4 |
MnCl2 | FeCl2 FeCl3 |
CoCl2 CoCl3 |
NiCl2 | CuCl CuCl2 |
ZnCl2 | GaCl2 GaCl3 |
GeCl2 GeCl4 |
AsCl3 AsCl5 |
Se2Cl2 SeCl4 |
BrCl | KrCl | ||
| RbCl | SrCl2 | YCl3 | ZrCl3 ZrCl4 |
NbCl4 NbCl5 |
MoCl2 MoCl3 MoCl4 MoCl5 MoCl6 |
TcCl4 | RuCl3 | RhCl3 | PdCl2 | AgCl | CdCl2 | InCl InCl2 InCl3 |
SnCl2 SnCl4 |
SbCl3 SbCl5 |
Te3Cl2 TeCl4 |
ICl ICl3 |
XeCl XeCl2 | ||
| CsCl | BaCl2 | HfCl4 | TaCl5 | WCl2 WCl3 WCl4 WCl5 WCl6 |
Re3Cl9 ReCl4 ReCl5 ReCl6 |
OsCl4 | IrCl2 IrCl3 IrCl4 |
PtCl2 PtCl4 |
AuCl AuCl3 |
Hg2Cl2, HgCl2 |
TlCl | PbCl2, PbCl4 |
BiCl3 | PoCl2, PoCl4 |
AtCl | RnCl2 | |||
| FrCl | RaCl2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| LaCl3 | CeCl3 | PrCl3 | NdCl2, NdCl3 |
PmCl3 | SmCl2, SmCl3 |
EuCl2, EuCl3 |
GdCl3 | TbCl3 | DyCl2, DyCl3 |
HoCl3 | ErCl3 | TmCl2 TmCl3 |
YbCl2 YbCl3 |
LuCl3 | |||||
| AcCl3 | ThCl4 | PaCl5 | UCl3 UCl4 UCl5 UCl6 |
NpCl4 | PuCl3 | AmCl2 AmCl3 |
CmCl3 | BkCl3 | CfCl3 | EsCl3 | Fm | Md | No | LrCl3 | |||||