இருபோரான் நாற்குளோரைடு
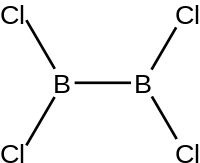
இருபோரான் நாற்குளோரைடு (Diboron tetrachloride) என்பது B2Cl4 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்டு ஒரு கனிம வேதியியல் சேர்மமாகும். தாழ் வெப்ப நிலைகளில் போரான் முக்குளோரைடின் மின்கசிவு செயல்முறை மூலமாக இச்சேர்மத்தைத் தயாரிக்கலாம்.:[1]
- BCl3 → BCl2 + Cl
- Cl + Hg(மின்வாய்) → HgCl அல்லது HgCl2
- 2BCl2 → B2Cl4
 | |
| பெயர்கள் | |
|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
Diboron tetrachloride | |
| முறையான ஐயூபிஏசி பெயர்
நாற்குளோரோ இருபோரேன் | |
| இனங்காட்டிகள் | |
| 13701-67-2 | |
| ChemSpider | 123068 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 139548 |
SMILES
| |
| பண்புகள் | |
| B2Cl4 | |
| வாய்ப்பாட்டு எடை | 163.433 கி/மோல் |
| தோற்றம் | நிறமற்ற திரவம் |
| அடர்த்தி | 1.5 கி/செ.மீ3 (0 °C) |
| உருகுநிலை | |
| கொதிநிலை | 65.5 °C (149.9 °F; 338.6 K) |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-523 கியூ/மோல் |
| நியம மோலார் எந்திரோப்பி S |
232.3 யூ/மோல் K |
| வெப்பக் கொண்மை, C | 137.7 யூ/மோல் K |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| Infobox references | |
வினைகள்
கரிமபுரோமின் சேர்மங்களை தொகுப்பு முறையில் தயாரிப்பதற்கான வினைப் பொருளாக இருபோரான் நாற்குளோரைடு பயன்படுகிறது. உதாரணமாக இது எத்திலீனுடன் ஈடுபடும் வினையைக் குறிப்பிடலாம்.:[2]
- CH2=CH2 + B2Cl4 → Cl2BCH2CH2BCl2
அறை வெப்பநிலையில் இச்சேர்மம் விரைவாக ஐதரசனை ஈர்த்துக் கொள்கிறது:[1]
- 3 B2Cl4 + 6H2 → 2 B2H6 + 4 BCl3
மேற்கோள்கள்
- Urry, Grant; Wartik, Thomas; Moore, R. E.; Schlesinger, H. I. (1954). Journal of the American Chemical Society 76 (21): 5293. doi:10.1021/ja01650a010.
- Urry, Grant; Kerrigan, James; Parsons, Theran D.; Schlesinger, H. I. (1954). Journal of the American Chemical Society 76 (21): 5299. doi:10.1021/ja01650a011.
| குளோரைடுகள் | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HCl | He | ||||||||||||||||||
| LiCl | BeCl2 | BCl3 B2Cl4 |
CCl4 | NCl3 ClN3 |
Cl2O ClO2 Cl2O7 |
ClF ClF3 ClF5 |
Ne | ||||||||||||
| NaCl | MgCl2 | AlCl AlCl3 |
SiCl4 | P2Cl4 PCl3 PCl5 |
S2Cl2 SCl2 SCl4 |
Cl2 | Ar | ||||||||||||
| KCl | CaCl CaCl2 |
ScCl3 | TiCl2 TiCl3 TiCl4 |
VCl2 VCl3 VCl4 VCl5 |
CrCl2 CrCl3 CrCl4 |
MnCl2 | FeCl2 FeCl3 |
CoCl2 CoCl3 |
NiCl2 | CuCl CuCl2 |
ZnCl2 | GaCl2 GaCl3 |
GeCl2 GeCl4 |
AsCl3 AsCl5 |
Se2Cl2 SeCl4 |
BrCl | KrCl | ||
| RbCl | SrCl2 | YCl3 | ZrCl3 ZrCl4 |
NbCl4 NbCl5 |
MoCl2 MoCl3 MoCl4 MoCl5 MoCl6 |
TcCl4 | RuCl3 | RhCl3 | PdCl2 | AgCl | CdCl2 | InCl InCl2 InCl3 |
SnCl2 SnCl4 |
SbCl3 SbCl5 |
Te3Cl2 TeCl4 |
ICl ICl3 |
XeCl XeCl2 | ||
| CsCl | BaCl2 | HfCl4 | TaCl5 | WCl2 WCl3 WCl4 WCl5 WCl6 |
Re3Cl9 ReCl4 ReCl5 ReCl6 |
OsCl4 | IrCl2 IrCl3 IrCl4 |
PtCl2 PtCl4 |
AuCl AuCl3 |
Hg2Cl2, HgCl2 |
TlCl | PbCl2, PbCl4 |
BiCl3 | PoCl2, PoCl4 |
AtCl | RnCl2 | |||
| FrCl | RaCl2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| LaCl3 | CeCl3 | PrCl3 | NdCl2, NdCl3 |
PmCl3 | SmCl2, SmCl3 |
EuCl2, EuCl3 |
GdCl3 | TbCl3 | DyCl2, DyCl3 |
HoCl3 | ErCl3 | TmCl2 TmCl3 |
YbCl2 YbCl3 |
LuCl3 | |||||
| AcCl3 | ThCl4 | PaCl5 | UCl3 UCl4 UCl5 UCl6 |
NpCl4 | PuCl3 | AmCl2 AmCl3 |
CmCl3 | BkCl3 | CfCl3 | EsCl3 | Fm | Md | No | LrCl3 | |||||
This article is issued from
Wikipedia.
The text is licensed under Creative
Commons - Attribution - Sharealike.
Additional terms may apply for the media files.