போரிக் அமிலம்
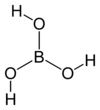
போரிக் அமிலம் (Boric acid) என்பது என்ற H3BO3 மூலக்கூற்று வாய்ப்பாடு கொண்ட போரானின் ஒற்றைக்கார இலூயிசு அமிலம் ஆகும். இதனுடைய மூலக்கூறு வாய்ப்பாட்டை சில சமயங்களில் B(OH)3) என்றும் எழுதுகிறார்கள். ஐதரசன் போரேட்டு, போராசிக் அமிலம், ஆர்தோபோரிக் அமிலம், அசிடம் போரிகம் என்ற பெயர்களாலும் போரிக் அமிலம் அழைக்கப்படுகிறது. பெரும்பாலும் இது கிருமி நாசினியாகவும், பூச்சிக் கொல்லியாகவும், தீத்தடுப்பானாகவும், நியூட்ரான் உறிஞ்சியாகவும், மற்ற வேதிச்சேர்மங்களை தயாரிக்க உதவும் முன்னோடியாகவும் எனப் பயன்படுத்தப்படுகிறது. போரிக் அமிலம் நிறமற்ற படிகங்கள் அல்லது வெண்ணிறத் தூளாகக் கிடைக்கிறது. போரிக் அமிலம் நீரில் கரையும். கனிமமாகக் கிடைக்கும் போது இது சாசோலைட்டு என்ற பெயரில் அழைக்கப்படுகிறது.
| |||
 | |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்s
போரிக் அமிலம் டிரைஐதராக்சிடோபோரான் | |||
| வேறு பெயர்கள்
ஆர்த்தோபோரிக் அமிலம், போராசிக் அமிலம், சாசோலைட்டு, ஓப்டிபோர், போரோஃபேக்சு, டிரைஐதராக்சிபோரேன், போரான்(III) ஐதராக்சைடு | |||
| இனங்காட்டிகள் | |||
| 10043-35-3 | |||
| ATC code | S02AA03 D08AD | ||
| ChEBI | CHEBI:33118 | ||
| ChEMBL | ChEMBL42403 | ||
| ChemSpider | 7346 | ||
| EC number | 233-139-2 | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image Image | ||
| KEGG | D01089 | ||
| பப்கெம் | 7628 | ||
SMILES
| |||
| UNII | R57ZHV85D4 | ||
| பண்புகள் | |||
| BH3O3 | |||
| வாய்ப்பாட்டு எடை | 61.83 g·mol−1 | ||
| தோற்றம் | வெண்ணிறப்படிகத்திண்மம் | ||
| அடர்த்தி | 1.435 கி/செமீ3 | ||
| உருகுநிலை | |||
| கொதிநிலை | 300 °C (572 °F; 573 K) | ||
| 2.52 கி/100 மிலி (0 °செ) 4.72 கி/100 மிலி (20 °செ) 5.7 கி/100 மிலி (25 °செ) 19.10 கி/100 மிலி (80 °செ) 27.53 கி/100 மிலி (100 °செ) | |||
| மற்ற கரைப்பான்கள்-இல் கரைதிறன் | மதுசாரத்தில் இலேசாகக் கரையும் பிரிடினில் மிதமாகக் கரையும் அசிட்டோனில் மிகக்குறைவாகக் கரையும் | ||
| காடித்தன்மை எண் (pKa) | 9.24, 12.4, 13.3 | ||
| கட்டமைப்பு | |||
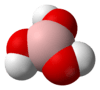
| மூலக்கூறு வடிவம் | |||
| இருமுனைத் திருப்புமை (Dipole moment) | சுழி | ||
| தீங்குகள் | |||
| ஈயூ வகைப்பாடு | |||
| R-சொற்றொடர்கள் | R60 R61 | ||
| S-சொற்றொடர்கள் | S53 S45 | ||
| தீப்பற்றும் வெப்பநிலை | எளிதில் தீப்பற்றாதது | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (Median dose) |
2660 மிகி/கிகி, வாய்வழி (எலி) | ||
| தொடர்புடைய சேர்மங்கள் | |||
| தொடர்புடைய சேர்மங்கள் | போரான் டிரைஆக்சைடு வெண்காரம் | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
தோற்றம்
போரிக் அமிலம், அல்லது சாசோலைட்டு எரிமலை இருக்கும் சில மாவட்டங்களில் காணப்படுகிறது, எடுத்துக்காட்டாக இத்தாலியப் பகுதியில் டசுக்கனி, லிபரி தீவுகள் மற்றும் அமெரிக்க மாநிலமான நெவாடா ஆகிய இடங்களில் முக்கியமாக அதன் தனித்த நிலையில் காணப்படுகிறது. இயற்கையாகத் தோன்றும் பல கனிமங்களின் ஒரு பகுதிப்பொருளாகவும் போரிக் அமிலம் காணப்படுகிறது. போராக்ஸ் (வெண்காரம்), போராசைட்டு, உலெக்சைட்டு, கோலிமானைட்டு என்பன போரான் காணப்படும் தனிமங்களுக்கு சில எடுத்துக்காட்டுகளாகும். போரிக் அமிலம் மற்றும் அதனுடைய உப்புக்கள் கடல் நீரில் காணப்படுகின்றன. இது கிட்டத்தட்ட அனைத்து பழங்களிலும் உள்ளடங்கி தாவரங்களிலும் காணப்படுகிறது [1]. போரிக் அமிலத்தை முதன்முதலில் வில்லெம் ஓம்பெர்க் என்பவர் போராக்சு கனிமத்துடன் கனிம அமிலங்களைச் சேர்த்து தயாரித்தார்
தயாரிப்பு
சோடியம் டெட்ராபொரேட்டு டெக்கா ஐதரேட்டு என்ற போராக்சுடன் ஐதரோகுளோரிக் அமிலத்தைச் சேர்த்து போரிக் அமிலம் தயாரிக்கப்படுகிறது.
- Na2B4O7•10H2O + 2 HCl → 4 B(OH)3 [or H3BO3] + 2 NaCl + 5 H2O
போரான் டிரை ஆலைடுகள் மற்றும் டைபோரேன் ஆகியவற்றை நீராற்பகுப்புக்கு உட்படுத்தியும் இதை தயாரிக்கிறார்கள் :[2]
- B2H6 + 6 H2O → 2 B(OH)3 + 6 H2
- BX3 + 3 H2O → B(OH)3 + 3 HX (X = Cl, Br, I).
பண்புகள்
கொதி நீரில் போரிக் அமிலம் கரைகிறது. இதை 170 பாகை செல்சியசு வெப்பநிலைக்கு சூடுபடுத்தினால் மெட்டா போரிக் அமிலம் உருவாகிறது (HBO2):
- H3BO3 → HBO2 + H2O
மெட்டா போரிக் அமிலம் வெண்மை நிறங் கொண்ட கனசதுர படிகவடிவம் கொண்ட ஒரு திண்மமாகும். தண்ணீரில் மிகச் சிறிதளவே கரையும். 236 பாகை செல்சியசு வெப்பநிலையில் மெட்டா போரிக் அமிலம் உருகும். 300 பாகை செல்சியசு வெப்பநிலைக்கு மேல் ஒருவேளை சூடுபடுத்தப்பட்டால் நீர் மூலக்கூறை இழக்கிறது. டெட்ராபோரிக் அமிலம் அல்லது பைரோபோரிக் அமிலம் உருவாகிறது. (H2B4O7):
- 4 HBO2 → H2B4O7 + H2O
போரிக் அமிலம் என்ற சொல் சில சமயங்களில் H2B4O7 சேர்மத்தையும் குறிக்கிறது. இதை மேலும் சூடாக்கினால் போரான் டிரை ஆக்சைடைக் கொடுக்கிறது.
- H2B4O7 → 2 B2O3 + H2O
நீரிய போரிக் அமில கரைசல்களின் அமிலத்தன்மை தோற்றம் குறித்த முரண்பட்ட விளக்கங்கள் காணப்படுகின்றன. வலிமையான காரங்களின் நிறமாலையியல் ஆய்வுகள் B(OH)−
4 அயனியின் இருப்பைக் காட்டுகின்றன.[3] இது தண்ணீரிலிருந்து OH− அயனியை இழுப்பதால் மட்டுமே உண்டாகிறது என்ற முடிவுக்கு கொண்டு சென்றது.:[3][4][5][6]
- B(OH)3 + H2O

4 + H+ (K = 7.3×10−10; pK = 9.14)
அல்லது மிகச்சரியாக சொல்வதென்றால் நீரிய கரைசல்களில் இது வெளிப்படுகிறது:
- B(OH)3 + 2 H2O

4 + H3O+
பிரான்சிடெட்டு அமிலத்தன்மை என்பதற்குப் பதிலாக இதை OH− அயனியை நோக்கிய போரானின் இலூயிசு அமிலத்தன்மை என்று வரையறுக்கவும் செய்யலாம்.[4][5][6] இருப்பினும் சில ஆதாரங்கள் போரிக் அமிலத்தை அடுத்தடுத்து அயனியாகும் படிநிலைகளும் அமிலத்தன்மையும் கொண்ட டிரைபேசிக் பிரான்சிடெட்டு அமிலம் என்று கூறுகின்றன.[7]
- B(OH)3

2 + H+ (Ka1 = 5.8x10−10; pKa1 = 9.24)
- BO(OH)−
2
- BO2(OH)2−

3 + H+ (Ka3 = 4x10−14; pKa3 = 13.3)
Ka1 இன் மதிப்பு OH− உடன் நிகழ்த்தும் வினையுடன் ஒப்பிடத்தக்க அளவில் உள்ளது. BO(OH)−
2 மற்றும் B(OH)−
4 இன் அடர்த்திகள் சமமாக உள்ளன.[7]
ஒருவேளை போரானின் அடர்த்தி 0.025 மோல்/லிட்டரை விட அதிகமாக இருந்தால் பாலிபோரேட்டு எதிர்மின் அயனிகள் காரகாடித்தன்மைச் சுட்டெண் 7–10 இல் தோன்றுகின்றன. போராக்சு கனிமத்தில் டெட்ராபோரேட்டு அயனி இருப்பது இதற்கு ஒரு நல்ல எடுத்துக்காட்டாகும்.
- 4[B(OH)4]− + 2H+

கடல் நீரில் குறைந்த அலை நீளம் கொண்ட ஒலி அலைகளை ஈர்ப்பதற்கு போரிக் அமிலம் முக்கிய பங்கு வகிக்கிறது [8]
வினைகள்
கிளிசரால், மானிட்டால் போன்ற பாலியால்களுடன் வினைபுரிகையில் கரைசலின் அமிலத்தன்மை சற்று அதிகரிக்கிறது. உதாரணமாக மானிட்டாலுடன் pK 5.15 என குறைகிறது. சிலியேட்டு [((OH)4C6H8O2)2B]− உருவாவது இதற்கு காரணமாகும். பகுப்பாய்வு வேதியியலில் இது பயன்படுகிறது.
நீரற்ற கந்தக அமிலத்தில் போரிக் அமிலம் கரைகிறது.
- B(OH)3 + 6H2SO4 → 3H3O+ + 2HSO4− + B(HSO4)4−
ஆல்ககால்களுடன் போரிக் அமிலம் வினைபுரிந்து போரேட்டு எசுத்தர்கள், B(OR)3 உருவாகின்றன. இங்கு R என்பது ஆல்கைல் அல்லது அரைல் குழுவைக் குறிக்கும். நீர் நீக்க முகவரான கந்தக அமிலம் இங்கு சேர்க்கப்படுகிறது :[9]
- B(OH)3 + 3 ROH → B(OR)3 +3 H2O.
மேற்கோள்கள்
- Allen, A. H.; Tankard, A. R. (1904). "The Determination of Boric Acid in Cider, Fruits, etc". Analyst 29 (October): 301–304. doi:10.1039/an9042900301. Bibcode: 1904Ana....29..301A.
- Housecroft, C. E.; Sharpe, A. G. (2008). "Chapter 13: The Group 13 Elements". Inorganic Chemistry (3rd ). Pearson. பக். 340. பன்னாட்டுத் தரப்புத்தக எண்:978-0-13-175553-6.
- Jolly, W. L. (1984). Modern Inorganic Chemistry. McGraw-Hill. பக். 198.
- Housecroft, C.E.; Sharpe, A.G. (2005). Inorganic Chemistry (2nd ). Pearson Prentice-Hall. பக். 314–5.
- MHE. "Comprehensive Chemistry for JEE Advanced 2014". Tata McGraw-Hill Education.
- Darpan, Pratiyogita (1 May 2000). "Competition Science Vision". Pratiyogita Darpan.
- Perelygin, Yu. P.; Chistyakov, D. Yu. (2006). "Boric acid" (PDF). Russian Journal of Applied Chemistry (Pleiades Publishing) 79 (12): 2041–2042. doi:10.1134/S1070427206120305. பன்னாட்டுத் தர தொடர் எண்:1070-4272. https://link.springer.com/content/pdf/10.1134%2FS1070427206120305.pdf. பார்த்த நாள்: 29 August 2013.
- "Underlying Physics and Mechanisms for the Absorption of Sound in Seawater". National Physical Laboratory. பார்த்த நாள் 2008-04-21.
- Brown, Herbert C.; Mead, Edward J.; Shoaf, Charles J. (1956). "Convenient Procedures for the Preparation of Alkyl Borate Esters". J. Am. Chem. Soc. 78 (15): 3613–3614. doi:10.1021/ja01596a015.