வெப்பக் கொண்மை
வெப்பக் கொண்மை, வெப்பக் கொள்ளளவு அல்லது வெப்பக் கொள்திறன் (heat capacity, thermal capacity) என்பது குறித்த நிறை உள்ள பொருளுக்கு எவ்வளவு வெப்ப ஆற்றலைத் தந்தால் அப்பொருளின் வெப்பநிலை ஒரு பாகை அளவுக்கு உயரும் என்பதைக் குறிக்கும் ஓர் அடிப்படையான பண்பு. அதே வேளை தன்வெப்பக்கொள்ளளவு (specific heat capacity) அல்லது தன்வெப்பக்கொண்மை என்பது ஓரலகு நிறையுடைய பொருளின் வெப்பநிலையை ஒரு பாகை அளவுக்குஉயர்த்தத் தேவையான வெப்ப ஆற்றலின் அளவினைக் குறிக்கும். இப் பண்பு 18 ஆம் நூற்றாண்டில் வாழ்ந்த சுகாட்லாந்து இயற்பியலாளர் யோசப் பிளாக் (1728-1799) என்பவரின் ஆய்வுகளின் வழி உணர்ந்த ஒன்று[1].
| பொருளின் பண்புகள் | |
|---|---|
| வெப்பக் கொண்மை | |
| அமுக்குமை | |
| வெப்ப நீண்மை | |
அதிக வெப்பக்கொண்மை உள்ள பொருளின் வெப்பநிலையைக் குறித்த அளவுக்கு உயர்த்த அதிக வெப்ப ஆற்றல் தேவைப்படும். 25 செல்சியசு வெப்பநிலையில் உள்ள ஒரு கிலோகிராம் எடையுள்ள நீரின்வெப்பநிலையை ஒரு பாகை கெல்வின் அளவுக்குக் கூட்டத் தேவைப்படும் வெப்ப ஆற்றல் 4.1813 கிலோஜூல் ஆகும். ஆகவே நீரின் தன்வெப்பக்கொண்மை 4.1813 கிஜூ/கிகி.கெ). ஆனால் ஒரு கிலோகிராம் எடையுள்ள தங்கத்தை (25 செல்சியசு), ஒரு பாகை கெல்வின் அளவு வெப்பநிலை உயர்த்தத் தேவைப்படும் வெப்ப ஆற்றல் அளவு 0.1291 கிஜூ/கிகி.கெ). மட்டுமே. ஆகவே தங்கத்தின் தன்வெப்பக்கொண்மை நீரின் தன்வெப்பக்கொண்மையை விடக் குறைவு.
வெப்பக்கொண்மையை குறித்த எடையுள்ள பொருளை அடிப்படையாகக் கொண்டு அளப்பதைப் போலவே ஒரு குறிப்பிட்ட கொள்ளளவு அல்லது பருமனளவு உள்ள பொருளுக்கு என அளப்பதும் வழக்கம். இதனை நிலைகொள்ளளவு வெப்பக்கொண்மை (c v) என்பர். அதே போல ஒரு குறிப்பிட்ட மூலக்கூறு எடை கொண்ட அளவுக்கும் (மோல் அளவுக்கும்) அளப்பதுண்டு. இதனை மோலார் வெப்பக் கொண்மை அல்லது மோலார் வெப்பக் கொள்திறன் என்று கூறுவர். இப்படி ஒரு மோலுக்கான வெப்பக் கொண்மையை அறியும் பொழுது பெரும்பாலும் எல்லாப் பொருளும் டியூலாங்-பெட்டிட் விதி வரையறை செய்த 25 கிஜூ/(மோல். கெ) அளவுக்குள்தான் இருக்கின்றன. ஆனால் அமோனியா, கார்பன்-டை-ஆக்சைடு போன்ற ஒருசில வளிமப் பொருள்களுக்குக் கூடுதலான மோல் வெப்பக்கொண்மை உள்ளன. சில பொருள்களின் வெப்பக் கொண்மைகள் கீழ்க்காணும் அட்டவணையில் கொடுக்கப்பட்டுள்ளன.
| பொருள் | பொருளின் இயல்நிலை | தன்வெப்பக்கொண்மை cp அல்லது cm kJ kg−1 K−1 |
நிலையழுத்த மோல் வெப்பக்கொண்மை Cp,m J mol−1 K−1 |
நிலைகொள்ளளவு மோல் வெப்பக்கொண்மை Cv,m J mol−1 K−1 |
கொள்ளளவு வெப்பக்கொண்மை J cm−3 K−1 |
|---|---|---|---|---|---|
| காற்றுமண்டல காற்று (கடல் மட்டம், உலர்ந்த, 0 °C) | வளிமம் | 1.0035 | 29.07 | 20.7643 | 0.001297 |
| காற்று (வழக்கமான அறை நிலைகளில்A) | வளிமம் | 1.012 | 29.19 | 20.85 | |
| அலுமினியம் | திண்மம் | 0.897 | 24.2 | 2.422 | |
| அமோனியா | நீர்மம் | 4.700 | 80.08 | 3.263 | |
| விலங்கு (மற்றும் மனித) இழையம்[2] | கலவை | 3.5 | - | 3.7* | |
| அந்திமணி | திண்மம் | 0.207 | 25.2 | 1.386 | |
| ஆர்கன் | வளிமம் | 0.5203 | 20.7862 | 12.4717 | |
| ஆர்சனிக் | திண்மம் | 0.328 | 24.6 | 1.878 | |
| பெரிலியம் | திண்மம் | 1.82 | 16.4 | 3.367 | |
| பிசுமத்[3] | திண்மம் | 0.123 | 25.7 | 1.20 | |
| செம்பு | திண்மம் | 0.385 | 24.47 | 3.45 | |
| கார்பன் டை ஆக்சைட்டு CO2[4] | வளிமம் | 0.839* | 36.94 | 28.46 | |
| வைரம் | திண்மம் | 0.5091 | 6.115 | 1.782 | |
| எதனோல் | நீர்மம் | 2.44 | 112 | 1.925 | |
| காசலின் | நீர்மம் | 2.22 | 228 | 1.64 | |
| கண்ணாடி[3] | திண்மம் | 0.84 | |||
| தங்கம் | திண்மம் | 0.1291 | 25.42 | 2.492 | |
| கருங்கல்[3] | திண்மம் | 0.790 | 2.17 | ||
| காரீயம் | திண்மம் | 0.710 | 8.53 | 1.534 | |
| ஈலியம் | வளிமம் | 5.1932 | 20.7862 | 12.4717 | |
| ஐதரசன் | வளிமம் | 14.30 | 28.82 | ||
| ஐதரசன் சல்பைட்டு H2S[4] | வளிமம் | 1.015* | 34.60 | ||
| இரும்பு | திண்மம் | 0.450 | 25.1 | 3.537 | |
| ஈயம் | திண்மம் | 0.127 | 26.4 | 1.44 | |
| லித்தியம் | திண்மம் | 3.58 | 24.8 | 1.912 | |
| மக்னீசியம் | திண்மம் | 1.02 | 24.9 | 1.773 | |
| பாதரசம் | திரவம் | 0.1395 | 27.98 | 1.888 | |
| நைதரசன் | வளிமம் | 1.040 | 29.12 | 20.8 | |
| நியான் | வளிமம் | 1.0301 | 20.7862 | 12.4717 | |
| ஒக்சிசன் | வளிமம் | 0.918 | 29.38 | ||
| பரவின் மெழுகு | திண்மம் | 2.5 | 900 | 2.325 | |
| சீலிக்கா (fused) | திண்மம் | 0.703 | 42.2 | 1.547 | |
| வெள்ளி[3] | திண்மம் | 0.233 | 24.9 | 2.44 | |
| தங்குதன்[3] | திண்மம் | 0.134 | 24.8 | 2.58 | |
| யுரேனியம் | திண்மம் | 0.116 | 27.7 | 2.216 | |
| நீர் (ஆவி) | வளிமம் (100 °C) | 2.080 | 37.47 | 28.03 | |
| நீர் | நீர்மம் (25 °C) | 4.1813 | 75.327 | 74.53 | 4.186 |
| நீர் (பனிக்கட்டி)[3] | திண்மம் (-10 °C) | 2.050 | 38.09 | 1.938 | |
| துத்த நாகம்[3] | திண்மம் | 0.387 | 25.2 | 2.76 | |
| All measurements are at 25 °C unless otherwise noted. Notable minima and maxima are shown in maroon. | |||||
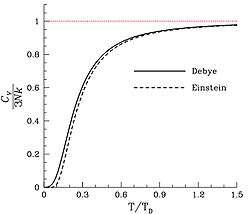
ஒரு பொருளில் உள்ள அணுத்தொடர்களின் அதிர்வெண் இயல்புகளைக் கொண்டு டிபை என்பவர் வெவ்வேறு வெப்பநிலைகளில் வெப்பக் கொண்மை எவ்வாறு மாறும் என்பது குறித்து டிபை விதி என்னும் ஒரு நெறிமுறையைத் தந்தார். ஐன்ஸ்டைன் இந்த டிபை விதியைவிட நெருக்கமான திருந்திய நெறிமுறை ஒன்றை வழங்கினார்.
உசாத்துணை
- Laider, Keith, J. (1993). The World of Physical Chemistry. Oxford University Press. பன்னாட்டுத் தரப்புத்தக எண்:0-19-855919-4.
- Page 183 in: Medical biophysics. Flemming Cornelius. 6th Edition, 2008. (also giving a density of 1.06 kg/l)
- Table of Specific Heats
- Textbook: Young and Geller College Physics, 8e, Pearson Education, 2008