எத்திலீன்
எத்திலீன் (Ethylene) என்பது C2H4. என்னும் வேதியியல் வாய்பாடு கொண்ட ஒரு கரிம வேதியியல் சேர்மமாகும். இதன் வேதிவாய்பாட்டை H2C=CH2 என்றும் எழுதலாம். தூய்மையான எத்திலீன் வாயு நிறமற்றது[2] . தீப்பற்றி எரியக்கூடியது. சற்றே இனிய மணம் கொண்டது ஆகும். ஐயுபிஏசி முறையில் எத்திலீனின் பெயர் எத்தீன் ஆகும். கார்பன் – கார்பன் இரட்டைப் பிணைப்பு கொண்ட ஐதரோகார்பன்களான ஆல்கீன்களில் எளிய ஆல்க்கீன் எத்திலீன் ஆகும்.
 | |
 | |
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்s
Ethene எத்தீன் | |
| இனங்காட்டிகள் | |
| 74-85-1 | |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
SMILES
| |
| பண்புகள் | |
| C2H4 | |
| வாய்ப்பாட்டு எடை | 28.05 கி/மோல் |
| தோற்றம் | நிறமற்ற வளிமம் |
| அடர்த்தி | 1.178 கி.கி/மீ3 15 °செ இல், வளிமம் [1] |
| உருகுநிலை | |
| கொதிநிலை | −103.7 °செ (169.5 K, -154.7 °F) |
| 3.5 மி.கி/100 மி.லி (17 °செ) | |
| காடித்தன்மை எண் (pKa) | 44 |
| கட்டமைப்பு | |
| மூலக்கூறு வடிவம் | |
| இருமுனைத் திருப்புமை (Dipole moment) | சுழி |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
+52.47 கியூ/மோல் |
| நியம மோலார் எந்திரோப்பி S |
219.32 J•K−1•மோல்−1 |
| தீங்குகள் | |
| ஈயூ வகைப்பாடு | மிக எளிதில் தீப்பிடிக்கும் (F+) |
| தொடர்புடைய சேர்மங்கள் | |
| தொடர்புடைய சேர்மங்கள் | எத்தீன் அசிட்டிலீன் |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| Infobox references | |
எத்திலீன் இரசாயனத் தொழிலில் பரவலாக பயன்படுத்தப்படுகிறது, மேலும் அதன் உலகளாவிய உற்பத்தி 2016 ஆம் ஆண்டில் 150 மில்லியன் டன்கள் ஆகும் [3]. வேறு எந்த கரிம சேர்மத்தையும் விட இது அதிகமாகத் தயாரிக்கப்பட்டுள்ளது [4][5].இந்த பெருமளவு உற்பத்தியின் பெரும்பகுதி பரவலாகப் பயன்படுத்தப்படும் நெகிழியான பாலியெத்திலீன் தயாரிப்பிற்காகப் பயன்படுத்தப்படுகிறது. பாலியெத்திலீன் எத்திலீன் அலகுகளால் ஆக்கப்பட்ட நீள நீளமான சங்கிலிகளால் ஆனது ஆகும். ஒரு தாவர நொதியாகவும் எத்திலீன் பயன்படுகிறது. காய்களை பழுக்கச் செய்ய இதைப் பயன்படுத்துவார்கள் [6]. எத்திலீனின் நீரேற்றே எத்தனால் ஆகும்.
கட்டமைப்பும் பண்புகளும்
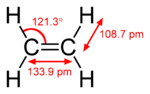
இந்த ஐதரோகார்பனில் நான்கு ஐதரசன் அணுக்கள் ஒரு சோடி கார்பன் அணுக்களுடன் இரட்டை பிணைப்பு மூலம் இணைக்கப்பட்டுள்ளன. அனைத்து ஆறு அணுக்களும் சேர்ந்து எத்திலீனுக்கு ஒருதள அமைப்பைக் கொடுக்கின்றன. H-C-H பிணைப்புக் கோணம் 117.4 ° ஆகும். இது சிறந்த sp² கலப்பின கார்பனின் 120 ° கோணத்திற்கு நெருக்கமாக உள்ளது. ஒப்பீட்டளவில் இம்மூலக்கூறு திடமானது ஆகும். C-C பிணைப்பு பற்றிய சுழற்சி என்பது ஓர் அதிக ஆற்றல் செயல்முறை ஆகும், இச்செயல் முறையில் அது π- பிணைப்பை முறித்துக் கொள்ள வேண்டியுள்ளது.
எத்திலீனின் பயனுள்ள வினைத்திறனுக்கு அதன் மூலக்கூறில் உள்ள π- பிணைப்பு பொறுப்பாகிறது. இரட்டைப் பிணைப்பு உள்ள பகுதி எலக்ட்ரான் அடர்த்தி அதிகமுள்ள பகுதியாக உள்ளது. அதனால் இப்பகுதி மின்னணு கவரிகளால் தாக்கப்பட்டு எளிதாய் பாதிக்கப்படும். எத்திலீனின் பல வினைகளுக்கு இடைநிலைத் தனிமங்கள் வினையூக்கியாக உள்ளன. இவை π மற்றும் π* ஒழுக்கல்களைப் பயன்படுத்தி தற்காலிகமாக எத்திலீனுடன் பிணைகின்றன.
எத்திலீன் ஓர் எளிய மூலக்கூறாக இருப்பதால் நிறமாலையிலும் எளிமையாகவே உள்ளது. இதனுடைய கட்புலனாகும் புற ஊதா நிறமாலை கோட்பாட்டு முறைகளுக்கு இன்னும் பயன்படுத்தப்படுகிறது [7].
பயன்கள்
எத்திலீனின் பிரதானமான தொழிற்துறை வினைகள் பின்வருமாறு அமைகின்றன. பலபடியாதல் 2) ஆக்சிசனேற்றம், 3) ஆலசனேற்றம் மற்றும் ஐதரோ ஆலசனேற்றம். 4) ஆல்கைலேற்றம், 5) நீரேற்றம்]], 6) சில்படிமமாதல் 7) ஐதரோபார்மைலேற்றம். அமெரிக்காவிலும் ஐரோப்பாவிலும் 90% எத்திலீன் எத்திலீன் ஆக்சைடு, எத்திலீன் டைகுளோரைடு, எத்தில்பென்சீன், பாலியெத்திலீன் போன்றவற்றை உற்பத்தி செய்யவே பயன்படுத்தப்படுகிறது [8]. எத்திலீன் ஈடுபடும் வினைகளில் பெரும்பாலானவை எலக்ட்ரான்கவர் கூட்டு வினைகளாகும்.
பலபடியாதல் வினை
உலக எத்திலீன் உற்பத்தியில் பாதிக்கும் மேற்பட்ட எத்திலீன் பாலி எத்திலீன் தயாரிக்கவே பயன்படுகின்றது. பாலியெத்திலீன் பாலியெத்தீன் என்ற பெயராலும் அழைக்கப்படுகிறது. இதுவே உலகில் பரவலாகப் பயன்படுத்தப்படும் நெகிழியாகும். பைகள் தயாரிக்க, பொட்டலம் கட்ட, குப்பைத் தொட்டிகள் தயாரிக்க என பல்வேறு பொருட்கள் இதிலிருந்து தயாரிக்கப்படுகின்றன. சில்படிமமாதல் முறையில் தயாரிக்கப்படும் நேரியல் ஆல்பா ஒலிபீன்களைப் பயன்படுத்தி அழுக்கு நீக்கிகள், நெகிழியாக்கிகள், செயற்கை உயவுப் பொருட்கள், சேர்க்கைப் பொருட்கள், பாலி எத்திலீன் தயாரிக்கப் பயன்படும் இணை ஒருமங்கள் ஆகியன தயாரிக்கப்படுகின்றன [8].
ஆக்சிசனேற்றம்
எத்திலீனை ஆக்சிசனேற்றம் செய்து எத்திலீன் ஆக்சைடு தயாரிக்கிறார்கள். ஈத்தாக்சிலேற்றம் மூலம் பரப்பியங்கிகள், அழுக்கு நீக்கிகள் தயாரிக்க உதவும் முக்கியமான மூலப்பொருளாக எத்திலீன் பயன்படுகிறது, எத்திலீன் ஆக்சைடை நீராற்பகுத்து எத்திலீன் கிளைக்கால் தயாரிக்கப்படுகிறது. இது வாகன் உறைதல் தடுப்பியாகவும், உயர் மூலக்கூறு எடை கிளைக்கால்கள் தயாரிக்கவும், கிளைக்கால் எசுத்தர்கள் மற்றும் பாலியெத்திலீன் டெரிப்தாலேட்டுகள் தயாரிக்கவும் பயன்படுகிறது. பலேடியத்தின் முன்னிலையில் ஆக்சிசனேற்றம் செய்யும்போது எத்திலீன் அசிட்டல்டிகைடைக் கொடுக்கிறது. இச்செயல்முறை ஒரு முக்கியமான தொழில்துறை செயல்முறையாகக் கருதப்படுகிறது [9].
ஆலசனேற்றம் மற்றும் ஐதரோ ஆலசனேற்றம்
எத்திலீன் டைகுளோரைடு, எத்தில் குளோரைடு, எத்திலீன் டைபுரோமைடு போன்ற சேர்மங்கள் எத்திலீனை ஆல்சனேற்றம் மற்றும் ஐதரோ ஆலசனேற்றம் செய்யும்போது இடைநிலை விளைபொருள்களாக உருவாகின்றன. மேலும் எத்திலீனை ஆக்சிகுளோரினேற்றம் செய்யும்போது பாலிவினைல் குளோரைடு, டிரைகுளோரோ எத்திலீன், பெர்குளோரோ எத்திலீன், மெத்தில் குளோரோபார்ம், பாலிவினைலிடின் குளோரைடு, எத்தில் புரோமைடு மற்றும் இணைபலபடிகள் முதலானவற்றை தயாரிக்கமுடியும்[10].
ஆல்கைலேற்றம்
எத்திலீனை ஆல்கைலேற்றம் செய்யும்போது இடைநிலைப் பொருளாக எத்தில்பென்சீன் தோன்றுகிறது. இது சிடைரின் தயாரிப்பதற்கான முன்னோடிச் சேர்மமாகும். சிடைரினைக் கொண்டு பாலிசிடைரின் தயாரிக்கலாம். இதை பொட்டலம் கட்டவும், மின்காப்பாகவும்பயன்படுத்துகிறார்கள். சிடைரின் பியூட்டாடையீன் இரப்பர் தயாரிக்கவும் இது பயன்படுகிறது. எத்தில் தொலுயீன், எத்தில் அனிலீன், 1,4- எக்சா டையீன் மற்றும் அலுமினியம் ஆல்கைல்கள் போன்றவற்றை சிறு அளவில் தயாரித்துக் கொள்ளவும் இது பயன்படுகிறது. இவற்றை தயாரிக்கும்போது பாலிசிடைரின், நிறைவுறா பாலியெசுட்டர்கள், டெர் பாலிமர்கள் போன்றவை இடைநிலை பொருள்களாகத் தோன்றுகின்றன[10].
மேற்கோள்கள்
- Record of Ethylene in the GESTIS Substance Database from the Institute for Occupational Safety and Health (IFA), accessed on 25 October 2007
- Zimmermann, Heinz; Walz, Roland (2008). "Ethylene". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a10_045.pub3.
- "The Ethylene Technology Report 2016 - Research and Markets". பார்த்த நாள் 19 June 2016.
- "Production: Growth is the Norm" (PDF). Chemical and Engineering News 84 (28): 59–236. July 10, 2006. doi:10.1021/cen-v084n034.p059.
- "Propylene Production from Methanol". by Intratec, ISBN 978-0-615-64811-8.
- Wang K, Li H, Ecker J; Li; Ecker (2002). "Ethylene Biosynthesis and Signaling Networks". Plant Cell 14 (Suppl): S131–51. doi:10.1105/tpc.001768. பப்மெட்:12045274.
- "Ethylene:UV/Visible Spectrum". NIST Webbook. பார்த்த நாள் 2006-09-27.
- "OECD SIDS Initial Assessment Profile — Ethylene" (PDF). inchem.org. பார்த்த நாள் 2008-05-21.
- Elschenbroich, C.; Salzer, A. (2006). Organometallics : A Concise Introduction (2nd ). Weinheim: Wiley-VCH. பன்னாட்டுத் தரப்புத்தக எண்:3-527-28165-7.
- Kniel, Ludwig; Winter, Olaf; Stork, Karl (1980). Ethylene, keystone to the petrochemical industry. New York: M. Dekker. பன்னாட்டுத் தரப்புத்தக எண்:0-8247-6914-7.
