மீத்தேன்
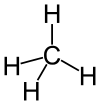
மீத்தேன் (Methane) என்பது CH4 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு வேதியியல் சேர்மமாகும். இதை மெத்தேன், கொள்ளிவாய் பிசாசு, சாணவாயு போன்ற பெயர்களாலும் அழைக்கிறார்கள். கார்பன் அணு ஒன்றும் நான்கு ஐதரசன் அணுக்களும் சேர்ந்து மீத்தேன் வாயு உருவாகிறது. இயற்கை வாயுவின் பெரும்பகுதி மீத்தேன் வாயுவாகும். தனிம வரிசை அட்டவனையின் 14 ஆவது குழுவைச் சேர்ந்த ஓர் ஐதரைடாகவும் ஓர் எளிய ஆல்கேனாகவும் மீத்தேன் கருதப்படுகிறது. ஒப்பீட்டளவில் மீத்தேன் பூமியில் அதிகமாகக் காணப்படுவதால் ஓர் எரிபொருளாக அனைவரின் கவனத்தையும் ஈர்க்கிறது. இருப்பினும் வாயுவாக இருப்பதால் அதை சாதாரண வெப்ப மற்றும் அழுத்த நிபந்தனைகளில் பெரிய சவால்களை எதிர்கொள்ள வேண்டியதாகிறது. பூமிக்கு அடியிலும் கடலுக்கு அடியிலும் இயற்கை மீத்தேன் கிடைக்கிறது. இந்த இயற்கை மீத்தேன் தரைப்பகுதியை அல்லது வளி மண்டலத்தை அடையும்போது வளிமண்டல மீத்தேன் என்ற பெயரைப் பெறுகிறது[1]. சூரிய மண்டலத்தின் அனைத்து கிரகங்களிலும் மற்றும் பெரிய நிலவுகள் பெரும்பாலானவற்றிலும் மீத்தேன் இருப்பதாக நம்பப்படுகிறது.
| மெத்தேன் | |
|---|---|
  | |
| பொது | |
| Other names | கொள்ளி வளி |
| மூலக்கூறு வாய்பாடு | CH4 |
| SMILES | C |
| மூலக்கூறு திணிவு | 16.04 கி/மோல் |
| புறத் தோற்றம் | நிறம் அற்ற வளிமம் |
| CAS எண் | [74-82-8] |
| பண்புகள் | |
| அடர்த்தி மற்றும் இயல் நிலை | 0.717 கி.கி/மீ3, வாயு |
| கரைமை in நீர் | 3.5 மி.லி கி/100 மி.லி (17 செ) |
| உருகும் நிலை | −182.5 °செ (90.6 கெ) |
| கொதி நிலை | −161.6 °செ (111.55 கெ) |
| முக்கூட்டு முப்புள்ளி நிலை | 90.7 கெ, 0.117 பார் |
| Critical வெப்ப நிலை | 190.5°கெ (−82.6 °செ) 4.6 மெகா பாசுக்கலில் (45 வளிமண்டல அழுத்தம்) |
| கட்டமைப்பு | |
| மூலக்கூறு வடிவம் | tetrahedral |
| Symmetry group | Td |
| Dipole moment | Zero |
| Hazards | |
| MSDS | External MSDS |
| EU classification | தீப்பற்றி எரியும் (F+) |
| என்.எப்.பி.ஏ 704 |
4
1
0
|
| R-சொற்றொடர்கள் | R12 |
| S-சொற்றொடர்கள் | (S2), S9, S16, S33 |
| தீ பற்றும் வெப்ப நிலை | −188 °செ |
| தானே தீப் பிடிக்கும் வெப்ப நிலை | 537 °C |
| பெரும எரியும் வெப்பநிலை: | 2148 °செ |
| வெடிக்கும் எல்லைs | 5–15% |
| மேலதிக தரவுகள் பக்கம் | |
| கட்டமைப்பும் பண்புகளும் | |
| வெப்பையக்கவியல் தரவுகள் | |
| Spectral data | UV, IR, NMR, MS |
| தொடர்புடைய கூட்டு வேதியியற் பொருட்கள் | |
| Related ஆல்க்கேன்கள் | எத்தேன் புரோப்பேன் |
| Related compounds | மெத்தனால் குளோரோமெத்தேன் |
| மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த் நிலையில் ( 25 °C, 100 kPa) இருக்கும் Infobox disclaimer and references | |
வரலாறு
1776 ஆம் ஆண்டு மீத்தேன் அறிவியல் பூர்வமாக முதன் முதலில் கண்டறியப்பட்டது. இத்தாலிய இயற்பியலாளர் அலிசேண்ட்ரோ வோல்ட்டா இதைக் கண்டுபிடித்தார். பெஞ்சமின் பிராங்களின் எழுதிய தீப்பற்றும் காற்று என்ற கட்டுரையை படித்த காரணத்தினாலேயே வோல்டாவிற்கு இதை ஆராய்ச்சி செய்யும் ஆர்வம் தோன்றியதாகக் கூறப்படுகிறது [2]. சதுப்பு நிலத்திலிருந்து வெளியேறிய வாயுவைச் சேகரித்த வோல்ட்டா அதிலிருந்து தூய்மையான மீத்தேன் வாயுவை தனித்துப் பிரித்தார் [3]. வாயு தீப்பற்றுவதை செயல் விளக்கமாகவும் மின்பொறியைப் பயன்படுத்தி செய்து காட்டினார் [3].
1866 இல் செருமானிய வேதியியலாளர் ஆகசுட்டு வில்லெம் வோன் ஆப்மான் இவ்வாயுவிற்கான பெயரை மெத்தனாலில் இருந்து தருவித்து மீத்தேன் என்று சூட்டினார்.
பிணைப்பும் பண்புகளும்
மீத்தேன் என்பது நான்கு சமமான C-H பிணைப்புகள் கொண்ட ஒரு நான்முகி மூலக்கூறு ஆகும். கார்பன் மற்றும் ஐதரசன் அணுக்கள் மீது இணைதிறன் ஆர்பிட்டால்கள் மேற்பொருந்துவதால் நான்கு பிணைப்பு மூலக்கூறு ஆர்பிட்டால்கள் தோன்றுகின்றன என மீத்தேனின் மின்னணு கட்டமைப்பு விவரிக்கப்படுகிறது. கார்பன் அணுவின் மீது 2s ஆர்பிட்டால்கள் மேற்பொருந்துவதால் குறைவு ஆற்றல் மூலக்கூற்று ஆர்பிட்டால்கள் தோன்றுகின்றன. இந்த ஆற்றல் மட்டத்திற்கு மேல் கார்பன் அணுவின் மீது 2p ஆர்பிட்டால்கள் மேற்பொருந்துகின்றன. மூன்றுக்கு மேல் ஒன்று பினையும் திட்டம் நான்முகி மூலக்கூறு எனப்படுகிறது.பல்வேறு நேரியல் ஒளிஎலக்ட்ரான் நிறமாலையியல் அளவீடுகளுக்கு இது சீரானதாக எடுத்துக் கொள்ளப்படுகிறது.
அறை வெப்பநிலை மற்றும் திட்ட அழுத்தத்தில் மீத்தேன் வாயு நிறமற்ற நெடியற்ற வாயுவாக உள்ளது[4]. வீடுகளில் பயன்படுத்தப்படும் இயற்கை எரிவாயுவின் வாசனைக்காகவும் பாதுகாப்பிற்காகவும் கூடுதலாக டெர்ட்-பியூட்டைல் தயால் சேர்க்கப்படுகிறது. ஓரலகு வளிமண்டல அழுத்தத்தில் மீத்தேனின் கொதிநிலை−164 °செல்சியசு வெப்பநிலையாகும் .[5]. சாதாரண அழுத்தத்தில் ஒரு வாயுவாக இது காற்றில் 5.4-17 சதவீதம் வரை வெவ்வேறு அடர்த்திகளில் தீப்பிடித்து எரிகிறது.
சில வேறுபாடுகளுடன் திண்மநிலை மீத்தேன் அறியப்படுகிறது. தற்பொழுது ஒன்பது வகையான திண்ம மீத்தேன்கள் அறியப்படுகின்றன[6].திண்ம மீத்தேனை சாதாரண அழுத்தத்தில் குளிர்ச்சியடையச் செய்தால் நீர்ம்நிலை மீத்தேன் கிடைக்கிறது. இது கனசதுரமாக Fm3m இடக்குழுவுடன் படிகமாகிறது. நீர்மநிலை மீத்தேனில் ஐதரசனின் இருப்பிடம் நிலையானதல்ல. மீத்தேன் மூலக்கூறுகள் சுதந்திரமாகச் சுழலும் என்பதால் நெகிழ்ச்சியான படிகங்கள் உருவாகின்றன [7].
வேதி வினைகள்
எரிதல், ஆலசனேற்றம், செயற்கை எரிவாயு உருவாக்கம். ஆலசனேற்றம் உள்ளிட்ட வினைகள் மீத்தேனின் முக்கியமான வேதி வினைகளாகும். பொதுவாக மெத்தனாலாக ஆக்சிசனேற்றம் அடையும் வினைகளைக் கட்டுப்படுத்துவது கடினமாகும். ஏனெனில் வினைக்காக குறைவான ஆக்சிசன் வழங்கப்பட்டாலும் கூட கார்பன் டை ஆக்சைடும் நீரும் உருவாதல் நிகழ்கிறது. மீத்தேன் மோனோ ஆக்சிசனேசு நொதி மீத்தேனிலிருந்து மெத்தனாலை உருவாக்குகிறது. ஆனால் தொழிற்சாலைகள் போல பெருமளவு தயாரிக்க இம்முறை உதவாது [8].
எரிதல் வினை
மீத்தேனின் எரிதல் வெப்பம் 55.5 மெ.யூ/கி.கி. மீத்தேனின் எரிதல் வினை பல படிகளைக் கொண்டது. இவற்றை தொகுத்து பின் வரும் ஒரே சமன்பாட்டில் கொடுக்கலாம். CH4 + 2 O2 → CO2 + 2 H2O (ΔH = −891 கியூJ/மோல் தர நிபந்தனைகளில் மீத்தேன் ஒரு எரிபொருளாகப் பயன்படுத்தப்படுகிறது.
ஆலசனேற்றம்
உரிய நிபந்தனைகளுக்கு உட்பட்டு மீத்தேன் ஆலசன்களுடன் வினைபுரிகிறது. X2 + UV → 2 X•
X• + CH4 → HX + CH3•
CH3• + X2 → CH3X + X•
இங்கு X என்பது ஒரு ஆலசனைக் குறிக்கும். புளோரின் (F), குளோரின் (Cl), புரோமின் (Br), அ;ல்லது அயோடின் (I) என்பவை அந்த ஆலசன்களாகும்.இச்செயல்முறையின் வழிமுறை இயங்குறுப்பு ஆலசனேற்றம் எனப்படுகிறது. புற ஊதா ஒளி மூலம் இவ்வினை தூண்டப்படுகிறது.
மேற்கோள்கள்
- Khalil, M. A. K. (1999). "Non-Co2 Greenhouse Gases in the Atmosphere". Annual Review of Energy and the Environment 24: 645–661. doi:10.1146/annurev.energy.24.1.645.
- Volta, Alessandro (1777) Lettere del Signor Don Alessandro Volta ... Sull' Aria Inflammable Nativa Delle Paludi [Letters of Signor Don Alessandro Volta ... on the flammable native air of the marshes], Milan, Italy: Giuseppe Marelli.
- "Methane". BookRags. பார்த்த நாள் January 26, 2012.
- Hensher, David A. & Button, Kenneth J. (2003). Handbook of transport and the environment. Emerald Group Publishing. பக். 168. பன்னாட்டுத் தரப்புத்தக எண்:0-08-044103-3. https://books.google.com/books?id=yp3qEgHrsJ4C&pg=PA168.
- Methane Phase change data. NIST Chemistry Webbook.
- Bini, R.; Pratesi, G. (1997). "High-pressure infrared study of solid methane: Phase diagram up to 30 GPa". Physical Review B 55 (22): 14800–14809. doi:10.1103/physrevb.55.14800.
- Wendelin Himmelheber. "Crystal structures". மூல முகவரியிலிருந்து August 9, 2016 அன்று பரணிடப்பட்டது. பார்த்த நாள் 2016-06-13.
- Baik, Mu-Hyun; Newcomb, Martin; Friesner, Richard A.; Lippard, Stephen J. (2003). "Mechanistic Studies on the Hydroxylation of Methane by Methane Monooxygenase". Chemical Reviews 103 (6): 2385–419. doi:10.1021/cr950244f. பப்மெட்:12797835.
| ஆல்க்கேன்கள் | |||||||||||||||||||||||||||||||
|
மெத்தேன் |
| |
எத்தேன் |
| |
புரொப்பேன் |
| |
பியூட்டேன் |
| |
பென்ட்டேன் |
| |
எக்சேன் |
|||||||||||||||||||||
|
எப்டேன் |
| |
ஆக்டேன் |
| |
நோனேன் |
| |
டெக்கேன் |
| |
ஆண்டெக்கேன் |
| |
டோடெக்கேன் |
| ||||||||||||||||||||

