பார்மால்டிகைடு
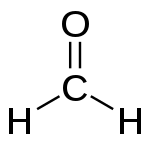
பார்மால்டிஹைடு இயற்கையில் கிடைக்கும் காிமச்சோ்மம் ஆகும். இதன் மூலக்கூறு வாய்ப்பாடு CH2O (H-CHO). இது மிக எளிய ஆல்டிஹைடு ஆகும். ஆல்டிஹைடு ஓாின வாிசையின் முதல் சோ்மம் இதுவாகும். இச்சோ்மத்தின் IUPAC பெயா் மீத்தேன்யால் ஆகும். இதன் பொதுப்பெயா் பார்மிக் அமிலத்தின் பண்புகளோடு ஒத்த தன்மையினால் ஏற்பட்டது ஆகும்.
| |||
 | |||
| பெயர்கள் | |||
|---|---|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
Formaldehyde[1] | |||
| முறையான ஐயூபிஏசி பெயர்
Methanal[1] | |||
| வேறு பெயர்கள்
Methyl aldehyde Methylene glycol Methylene oxide Formalin (aqueous solution) Formol Carbonyl hydride | |||
| இனங்காட்டிகள் | |||
| 50-00-0 | |||
| 3DMet | B00018 | ||
Beilstein Reference |
1209228 | ||
| ChEBI | CHEBI:16842 | ||
| ChEMBL | ChEMBL1255 | ||
| ChemSpider | 692 | ||
| DrugBank | DB03843 | ||
| EC number | 200-001-8 | ||
Gmelin Reference |
445 | ||
InChI
| |||
IUPHAR/BPS |
4196 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| KEGG | D00017 | ||
| ம.பா.த | Formaldehyde | ||
| பப்கெம் | 712 | ||
| வே.ந.வி.ப எண் | LP8925000 | ||
SMILES
| |||
| UNII | 1HG84L3525 | ||
| UN number | 2209 | ||
| பண்புகள் | |||
| CH2O | |||
| வாய்ப்பாட்டு எடை | 30.03 g·mol−1 | ||
| தோற்றம் | Colorless gas | ||
| அடர்த்தி | 0.8153 g/cm3 (−20 °C)[2] | ||
| உருகுநிலை | |||
| கொதிநிலை | −19 °C (−2 °F; 254 K)[2] | ||
| 400 g dm−3 | |||
| மட. P | 0.350 | ||
| ஆவியமுக்கம் | < 1 atm[3] | ||
| காடித்தன்மை எண் (pKa) | 13.27 [4][5] | ||
காந்த ஏற்புத்திறன் (χ) |
-18.6·10−6 cm3/mol | ||
| இருமுனைத் திருப்புமை (Dipole moment) | 2.33 D | ||
| கட்டமைப்பு | |||
| மூலக்கூறு வடிவம் | |||
| தீங்குகள் | |||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | MSDS | ||
| ஈயூ வகைப்பாடு | Toxic (T) Corrosive (C) Carc. Cat. 1 | ||
| R-சொற்றொடர்கள் | R23/24/25 R34 R43 R45 | ||
| S-சொற்றொடர்கள் | (S1/2) S26 S36/37/39 S45 S51 S53 S60 | ||
| தீப்பற்றும் வெப்பநிலை | 64 °C (147 °F; 337 K) | ||
Autoignition temperature |
430 °C (806 °F; 703 K) | ||
| வெடிபொருள் வரம்புகள் | 7–73% | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (Median dose) |
100 mg/kg (oral, rat)[6] | ||
LC50 (Median concentration) |
333 ppm (mouse, 2 hr) 815 ppm (rat, 30 min)[7] | ||
LCLo (Lowest published) |
333 ppm (cat, 2 hr)[7] | ||
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |||
அனுமதிக்கத்தக்க வரம்பு |
TWA 0.75 ppm ST 2 ppm (as formaldehyde and formalin)[8][9] | ||
பரிந்துரைக்கப்பட்ட வரம்பு |
Ca TWA 0.016 ppm C 0.1 ppm [15-minute][8] | ||
உடனடி அபாயம் |
Ca [20 ppm][8] | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
பார்மால்டிஹைடானது பல வேதிப்பொருட்களுக்கும் மற்றும் பல தொகுப்புப்பொருட்களுக்கும் முதல் நிலைப் பொருளாக விளங்குகிறது. 1996 ஆம் ஆண்டில் பார்மால்டிஹைடின் உற்பத்தி அளவானது ஆண்டொன்றுக்கு 8.7 மில்லியன் டன்களாகும்.[10] இது முக்கியமாக தொழிற்துறைக்கான பிசின்கள் தயாாிப்பில் அதிக அளவில் பயன்பட்டது.
இதனுடைய பரந்துபட்ட பயன்பாடு, நச்சுத்தன்மை, எளிதில் மாறும் தன்மை ஆகியவற்றின் காரணமாக மனித உடல் நலத்திற்கு குறிப்பிடத்தக்க ஆபத்தை விளைவிக்கக்கூடியதாக இருந்தது.[11] 2011 ஆம் ஆண்டில் அமொிக்க தேசிய நச்சுயியல் திட்டமானது பார்மால்டிஹைடை மனித உயிா் செல்களில் புற்றுநோயை விளைவிக்கும் காரணியாக அறிவித்தது.[12][13][14]
வரலாறு
முதன் முதலாக இரசிய வேதியியலாளா் அலெக்சாண்டா் புட்லெரோவ் (1828–86) என்பவரால் பார்மால்டிறைடு என்ற சேர்மத்தின் இருப்பு அறிவிக்கப்பட்டது. (1828–86) ஆனால், இவா் பார்மால்டிஹைடை டைஆக்சிமெதிலீன் என அழைத்தாா்.[15] இறுதியாக ஆகஸ்ட் வில்ஹெம் வான் ஹாப்மேன் என்பவரால் பார்மால்டிஹைடின் சரியான வடிவம் மற்றும் தயாாிப்பு 1869 ஆம் ஆண்டு கண்டுபிடிக்கப்பட்டது.[16][17]
பார்மால்டிஹைடின் வடிவங்கள்
பார்மால்டிஹைடானது பல எளிய கார்பன் சோ்மங்களோடு ஒப்பிடும் போது சற்றே சிக்கலான வடிவமைப்பைப் பெற்றுள்ளது. மேலும், பல வெவ்வேறு வடிவங்களைப் பெற்றதாகவும் உள்ளது. ஒரு வாயுவாக, பார்மால்டிஹைடானது ஒரு நிறமற்ற குறிப்பிடத்தக்க கடுமையான எாிச்சலுாட்டும் வாசனையைக் கொண்டதாக உள்ளது. ஒடுக்கமடையும் போது இந்த வாயு கூடுதல் நடைமுறைப் பயன்களையுடை பல வெவ்வேறு வடிவங்களுக்கு மாறுகிறது. இத்தகைய ஒரு வழிப்பொருளானது (CH2O)3 என்ற மூலக்கூறு வாய்ப்பாட்டை உடைய வளைய மெட்டா பார்மால்டிஹைடு அல்லது (1,3,5-ட்ரை ஆக்சேன்) ஆக உள்ளது. மேலும், ஒரு நோ்கோட்டு வடிவமுடைய பாராபாா்மால்டிஹைடு எனப்படும் வடிவமும் காணப்படுகிறது. இந்த சோ்மங்களானது ஒத்த வேதிப்பண்புகளைக் கொண்டு பெரும்பாலும் ஒன்றுக்கு ஒன்று மாற்றாகப் பயன்படுத்தப்படுகின்றன.
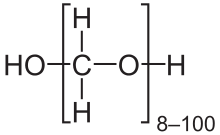
பார்மால்டிஹைடானது நீாில் கரைக்கப்படும் போது H2C(OH)2 எனும் மூலக்கூறு வாய்ப்பாட்டை உடைய மீத்தேன்டையால் எனும் ஹைட்ரேட்டை உருவாக்குகிறது. கரைசலின் செறிவு மற்றும் வெப்பநிலையைப் பொறுத்த இந்த சோ்மமானது பல குறும் பல்படிகளுடன் சமநிலையில் இருக்கிறது. கன அளவு விகிதாச்சாரத்தின் படி 40% அல்லது எடை விகிதாச்சாரப்படி 37% பார்மால்டிஹைடைக் கொண்ட நீரின் தெவிட்டிய கரைசல் பார்மலின் என அழைக்கப்படுகிறது. இதனுடன் சிறிய அளவு மெதனால் போன்ற சீராக்கி ஆக்சிஜனேற்றம் மற்றும் பலபடியாதல் வினைகளை தடுப்பதற்காக சோ்க்கப்படுகிறது. வணிகரீதியிலான பார்மலின் 10–12% மெதனாலைக் கொண்டிருக்கலாம். பார்மலின் என்ற இந்தப் பெயரானது வணிகரீதியில் மிக நீண்ட நெடுங்காலமாகப் பயன்படுத்தப்பட்டு வந்துள்ளது.[18]
தொழில்முறை தயாாிப்பு
பாா்மால்டிஹைடானது தொழில் முறையில் மெத்தனால் -இனை வினைவேக மாற்றி முன்னிலையில் ஆக்சிஜனேற்றம் செய்வதன் மூலம் தயாாிக்கப்படுகிறது. இந்த வினையில், வெள்ளி உலோகம் அல்லது இரும்பு ஆக்சைடு மற்றும் மாலிப்டினம் ஆக்சைடு கலந்த கலவை அல்லலது வெனடியம் பெண்டாக்சைடு ஆகியவை பொதுவாகப் பயன்படுத்தப்படும் வினைவேக மாற்றிகளாகும். பொதுவாகப் பயன்படுத்தப்படும் பார்மாக்ஸ் வினையில் மெதனால் மற்றும் ஆக்சிஜன் ஆகியவை ca. 250–400 °C வெப்பநிலையில் மாலிப்டினம் மற்றும் வெனடியம் உடன் இரும்பு ஆக்சைடு அல்லது வெனடியம் உடன் இரும்பு ஆக்சைடு முன்னிலையில் பின்வரும் வேதிச்சமன்பாட்டின்படி வினைபுாிந்து பார்மால்டிஹைடைத் தருகின்றன. :[10]
- 2 CH3OH + O2 → 2 CH2O + 2 H2O
வெள்ளியை அடிப்படையாகக் கொண்ட வினைவேகமாற்றி முன்னிலையில் பொதுவாக உயா் வெப்பநிலையில் (அதாவது 650 °C) மேலே குறிப்பிடப்பட்ட வேதிவினையும், ஹைட்ரஜன் நீக்க வினையும் ஒரே நேரத்தில் நடைபெற்று பார்மால்டிஹைடைத் தருகிறது.
- CH3OH → CH2O + H2
கொள்கை அளவில் பார்மால்டிஹைடை மீத்தேனை ஆக்சிஜனேற்றம் செய்தும் பெற முடியும். ஆனால், தொழில் முறையில் மீத்தேனை ஆக்சிஜனேற்றம் செய்வதை விட மெதனாலை ஆக்சிஜனேற்றம் செய்வது எளிதானதாக இருக்கிறது.
தொழிற்துறை பயன்கள்
பார்மால்டிஹைடானது பல சிக்கலான சோ்மங்கள் மற்றும் பொருட்களின் பொதுவான முன்னோடி சோ்மமாக உள்ளது. யூாியா பார்மால்டிஹைடு பிசின், மேலமைன் பிசின், பீனால் பார்மால்டிஹைடு பிசின், பாலிஆக்சிமெதிலீன் பிளாஸ்டிக்குகள், 1,4-பியூட்டேன்டையால் ஆகியவை பார்மால்டிஹைடிலிருந்து பெறப்படும் சிக்கலான பொருட்களாகும்.[10] ஜவுளித்துறையில் பார்மால்டிஹைடை அடிப்படையாகக் கொண்ட பிசின்களை துணிகளை இறுதி செய்யும் பணியில் துணிகளில் கறை படியாமல் இருக்கச் செய்வதற்காக பயன்படுத்துகின்றனா்.[19] பார்மால்டிஹைiடை அடிப்படையாகக் கொண்ட பொருட்கள் தானியங்கி வாகனங்களின் உற்பத்திக்கு முக்கியமான ஒலிபரப்பு, மின் அமைப்பு, இயந்திர தொகுதி, கதவு பேனல்கள், அச்சுகள் மற்றும் நிறுத்த மிதி ஆகியவற்றிற்கான கூறுகளை உருவாக்க பயன்படுத்தப்படுகின்றன. 2003 ஆம் ஆண்டில் பார்மால்டிஹைடு மற்றும் அதன் வழிப்பொருட்களின் தயாரிப்புகளின் விற்பனை மதிப்பு 145 பில்லியன் டாலருக்கும் அதிகமாக இருந்தது, அமெரிக்கா மற்றும் கனடா மொத்த உள்நாட்டு உற்பத்தியில் 1.2% ஆக இருந்தது. மறைமுக வேலைவாய்ப்பு உட்பட, அமெரிக்க மற்றும் கனடாவில் 11,900 ஆலைகளில், சுமார் 4 மில்லியன் மக்களுக்கு பார்மால்டிஹைடு தொழிலில் வேலைவாய்ப்பு கிடைத்தது.[20]
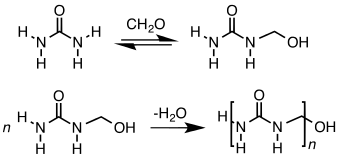
பார்மால்டிஹைடை பீனால், யூரியா, மேலமீன், ஆகியவற்றுடன் வினைப்படுத்தும் போது முறையே, வெப்பத்தால் இறுகும் பீனால் பார்மால்டிஹைடு பிசின், யூாியா பார்மால்டிஹைடு பிசின், மேலமீன் பிசின் ஆகியவை உருவாக்கப்படுகின்றன. இந்தப் பலபடி மூலக்கூறுகள் ஒட்டுபலகைகள் மற்றும் கம்பளவிாிப்புகளுக்கான பொதுவான மற்றும் நிரந்தரமான ஒட்டும் பசைகளாகின்றன.
மேற்கோள்கள்
- Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. பக். 908. doi:10.1039/9781849733069-FP001. பன்னாட்டுத் தரப்புத்தக எண்:978-0-85404-182-4.
- Formaldehyde (PDF), SIDS Initial Assessment Report, International Programme on Chemical Safety
- Spence, Robert, and William Wild. "114. The vapour-pressure curve of formaldehyde, and some related data." Journal of the Chemical Society (Resumed) (1935): 506-509
- https://pubchem.ncbi.nlm.nih.gov/compound/formaldehyde#section=Odor-Threshold
- http://chemistry.stackexchange.com/questions/12232/acidity-of-aldehydes
- http://chem.sis.nlm.nih.gov/chemidplus/rn/50-00-0
- "Formaldehyde". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- "NIOSH Pocket Guide to Chemical Hazards #0293". National Institute for Occupational Safety and Health (NIOSH).
- "NIOSH Pocket Guide to Chemical Hazards #0294". National Institute for Occupational Safety and Health (NIOSH).
- Günther Reuss, Walter Disteldorf, Armin Otto Gamer, Albrecht Hilt "Formaldehyde" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. எஆசு:10.1002/14356007.a11_619
- "Formaldehyde" (PDF), Formaldehyde, 2-Butoxyethanol and 1-tert-Butoxypropan-2-ol, IARC Monographs on the Evaluation of Carcinogenic Risks to Humans 88, Lyon, France: International Agency for Research on Cancer, 2006, pp. 39–325, பன்னாட்டுத் தரப்புத்தக எண்:92-832-1288-6, http://monographs.iarc.fr/ENG/Monographs/vol88/mono88-6.pdf வார்ப்புரு:11thRoC
- Harris, Gardiner (10 June 2011). "Government Says 2 Common Materials Pose Risk of Cancer". New York Times. https://www.nytimes.com/2011/06/11/health/11cancer.html. பார்த்த நாள்: 2011-06-11.
- National Toxicology Program (10 June 2011). "12th Report on Carcinogens". National Toxicology Program. பார்த்த நாள் 2011-06-11.
- National Toxicology Program (10 June 2011). "Report On Carcinogens – Twelfth Edition – 2011" (PDF). National Toxicology Program. பார்த்த நாள் 2011-06-11.
- A. Butlerow (1859) "Ueber einige Derivate des Jodmethylens" (On some derivatives of methylene iodide), Annalen der Chemie und Pharmacie, vol . 111, pages 242–252. In this paper, Butlerov discovered formaldehyde, which he called "Dioxymethylen" (methylene dioxide) [page 247] because his empirical formula for it was incorrect (C4H4O4).
- In 1867, A. W. Hofmann first announced to the Royal Prussian Academy of Sciences the production of formaldehyde by passing methanol vapor in air over hot platinum wire. See: A. W. Hofmann (14 October 1867) "Zur Kenntnis des Methylaldehyds" ([Contributions] to our knowledge of methylaldehyde), Monatsbericht der Königlich Preussischen Akademie der Wissenschaften zu Berlin (Monthly Report of the Royal Prussian Academy of Sciences in Berlin), vol. 8, pages 665–669. Reprinted in:
- A.W. Hofmann, (1868) "Zur Kenntnis des Methylaldehyds", Annalen der Chemie und Pharmacie (Annals of Chemistry and Pharmacy), vol. 145, no. 3, pages 357–361.
- A.W. Hofmann (1868) "Zur Kenntnis des Methylaldehyds", Journal für praktische Chemie (Journal for Practical Chemistry), vol. 103, no. 1, pages 246–250.
- Hofmann, A.W. (1869). "Beiträge zur Kenntnis des Methylaldehyds". Journal für Praktische Chemie 107 (1): 414–424. doi:10.1002/prac.18691070161. https://books.google.com/books?id=2AIwAAAAIAAJ&pg=PA414#v=onepage&q&f=false.
- A.W. Hofmann (1869) "Beiträge zur Kenntnis des Methylaldehyds," Berichte der Deutschen Chemischen Gesellschaft (Reports of the German Chemical Society), vol. 2, pages 152–159.
- Read, J. (1935). Text-Book of Organic Chemistry. London: G Bell & Sons.
- Merriam-Webster, Merriam-Webster's Collegiate Dictionary, Merriam-Webster, http://unabridged.merriam-webster.com/collegiate/.
- "Formaldehyde in Clothing and Textiles FactSheet". Australian National Industrial Chemicals Notification and Assessment Scheme (May 2013). பார்த்த நாள் 12 November 2014.
- Economic Importance, Formaldehyde Council. 2009. Accessed on April 14, 2010.