டெர்பியம் (III) குளோரைடு
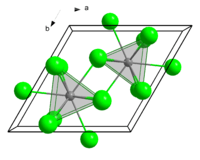
டெர்பியம் (III) குளோரைடு (Terbium(III) Chloride) என்பது TbCl3 என்ற மூலக்கூறு வாய்பாடுடன் கூடிய ஒரு வேதிச் சேர்மமாகும். திண்ம நிலையில் இயிற்றியம் முக்குளோரைடு அடுக்கின் அமைப்பை டெர்பியம் (III) குளோரைடும் பெற்றுள்ளது[1]. டெர்பியம் (III) குளோரைடு பெரும்பாலும் அறுவைதரேட்டுகளை உருவாக்குகிறது.
| |||
| பெயர்கள் | |||
|---|---|---|---|
| வேறு பெயர்கள்
டெர்பியம் முக்குளோரைடு | |||
| இனங்காட்டிகள் | |||
| 10042-88-3 | |||
| EC number | 233-132- | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 61458 | ||
SMILES
| |||
| பண்புகள் | |||
| TbCl3 | |||
| வாய்ப்பாட்டு எடை | 265.2834 கி/மோல் | ||
| தோற்றம் | வெண்மைநிறத் துகள் | ||
| அடர்த்தி | 4.35 கி/செமீ3, திண்மம் | ||
| உருகுநிலை | |||
| கரையும் | |||
| கட்டமைப்பு | |||
| படிக அமைப்பு | அறுங்கோணம் (UCl3 type), hP8 | ||
| புறவெளித் தொகுதி | P63/m, No. 176 | ||
| ஒருங்கிணைவு வடிவியல் |
முக்கோண முப்பட்டக அமைப்பு (ஒன்பது-அச்சுத்தூரம்) | ||
| தீங்குகள் | |||
| ஈயூ வகைப்பாடு | பட்டியலிடப்படவில்லை | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | டெர்பியம்(III)ஆக்சைடு | ||
| ஏனைய நேர் மின்அயனிகள் | கடோலினியம்(III)குளோரைடு டிசிப்ரோசியம்(III)குளோரைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
தீங்குகள்
டெர்பியம் (III) குளோரைடு உபயோகிக்கையில் வெப்பம், அமிலங்கள், அமில ஆவி ஆகியனவற்றிடம் இருந்து விலகியிருக்க வேண்டும். கருவிழிப்படலத்தில் மிகைக்குருதிமை பாதிப்பை டெர்பியம் (III) குளோரைடு ஏற்படுத்துகிறது[2].
மேற்கோள்கள்
- Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- George C. Y. Chiou (1999). Ophthalmic toxicology (2nd ). CRC Press. பன்னாட்டுத் தரப்புத்தக எண்:1-56032-722-7.
| குளோரைடுகள் | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HCl | He | ||||||||||||||||||
| LiCl | BeCl2 | BCl3 B2Cl4 |
CCl4 | NCl3 ClN3 |
Cl2O ClO2 Cl2O7 |
ClF ClF3 ClF5 |
Ne | ||||||||||||
| NaCl | MgCl2 | AlCl AlCl3 |
SiCl4 | P2Cl4 PCl3 PCl5 |
S2Cl2 SCl2 SCl4 |
Cl2 | Ar | ||||||||||||
| KCl | CaCl CaCl2 |
ScCl3 | TiCl2 TiCl3 TiCl4 |
VCl2 VCl3 VCl4 VCl5 |
CrCl2 CrCl3 CrCl4 |
MnCl2 | FeCl2 FeCl3 |
CoCl2 CoCl3 |
NiCl2 | CuCl CuCl2 |
ZnCl2 | GaCl2 GaCl3 |
GeCl2 GeCl4 |
AsCl3 AsCl5 |
Se2Cl2 SeCl4 |
BrCl | KrCl | ||
| RbCl | SrCl2 | YCl3 | ZrCl3 ZrCl4 |
NbCl4 NbCl5 |
MoCl2 MoCl3 MoCl4 MoCl5 MoCl6 |
TcCl4 | RuCl3 | RhCl3 | PdCl2 | AgCl | CdCl2 | InCl InCl2 InCl3 |
SnCl2 SnCl4 |
SbCl3 SbCl5 |
Te3Cl2 TeCl4 |
ICl ICl3 |
XeCl XeCl2 | ||
| CsCl | BaCl2 | HfCl4 | TaCl5 | WCl2 WCl3 WCl4 WCl5 WCl6 |
Re3Cl9 ReCl4 ReCl5 ReCl6 |
OsCl4 | IrCl2 IrCl3 IrCl4 |
PtCl2 PtCl4 |
AuCl AuCl3 |
Hg2Cl2, HgCl2 |
TlCl | PbCl2, PbCl4 |
BiCl3 | PoCl2, PoCl4 |
AtCl | RnCl2 | |||
| FrCl | RaCl2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| LaCl3 | CeCl3 | PrCl3 | NdCl2, NdCl3 |
PmCl3 | SmCl2, SmCl3 |
EuCl2, EuCl3 |
GdCl3 | TbCl3 | DyCl2, DyCl3 |
HoCl3 | ErCl3 | TmCl2 TmCl3 |
YbCl2 YbCl3 |
LuCl3 | |||||
| AcCl3 | ThCl4 | PaCl5 | UCl3 UCl4 UCl5 UCl6 |
NpCl4 | PuCl3 | AmCl2 AmCl3 |
CmCl3 | BkCl3 | CfCl3 | EsCl3 | Fm | Md | No | LrCl3 | |||||
This article is issued from
Wikipedia.
The text is licensed under Creative
Commons - Attribution - Sharealike.
Additional terms may apply for the media files.
_2.png)