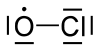குளோரின் ஓராக்சைடு
குளோரின் ஓராக்சைடு (Chlorine monoxide) என்பது ClO என்ற மூலக்கூற்று வாய்ப்பாடுடன் கூடிய ஒரு வேதியியல் தனியுறுப்பு ஆகும். ஓசோன் குறைபாட்டில் இச்சேர்மம் முக்கியப் பங்கு வகிக்கிறது. படைமண்டலத்தில் குளோரின் அணுக்கள் ஓசோன் மூலக்கூறுகளுடன் வினைபுரிந்து குளோரின் ஓராக்சைடு மற்றும் ஆக்சிசன் ஆகியன உருவாகின்றன.
- Cl· + O
3 → ClO· + O
2
| |||
| பெயர்கள் | |||
|---|---|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
Chlorine monoxide | |||
| முறையான ஐயூபிஏசி பெயர்
குளோரோஆக்சிடனைல் | |||
| வேறு பெயர்கள்
குளோரின்(II)ஆக்சைடு | |||
| இனங்காட்டிகள் | |||
| 12301-79-0 | |||
| Abbreviations | ClO(.) | ||
| ChEBI | CHEBI:29314 | ||
| ChemSpider | 145843? | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| ம.பா.த | Chlorosyl | ||
| பப்கெம் | 166686 | ||
SMILES
| |||
| பண்புகள் | |||
| ClO | |||
| வாய்ப்பாட்டு எடை | 51.45 g·mol−1 | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
101.8 கிஜூ/மோல்[1] | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| Infobox references | |||
இவ்வினையின் விளைவாக ஓசோன் அடுக்கில் குறைபாடு ஏற்படுகிறது[1] . இவ்வினை அங்கு தொடர்ந்து நிகழ்வதால் குளோரின் ஓராக்சைடு உறுப்புகள் மேலும் ஆக்சிசன் உறுப்புடன் வினைபுரிந்து குளோரின் தனியுறுப்பை மீட்டாக்கம் செய்கின்றன.
- ClO· + O· → Cl· + O
2
இதே வழியில் ஒட்டுமொத்த வினையையும் கவனித்தால் குளோரின் வினையூக்கியாக மட்டும் செயற்பட்டு மாற்றமேதுமின்றி ஓசோன் குறைபாடு நிகழ காரணமாகிறது.
- O· + O
3 → + 2O
2
என்பது இங்கு நிகழும் ஒட்டுமொத்த வினையாகும்.
குளோரோபுளோரோகார்பன்களை உபயோகிப்பது மேல்படை மண்டலத்தில் குறிப்பிடத்தகுந்த தாக்கத்தை ஏற்படுத்துகிறது. வினைபுரியும் தன்மையற்ற குளோரோபுளோரோகார்பன் படைமண்டலத்திற்குள் எளிதாக ஊடுறுவுகிறது. பின்னர் அங்கு ஒளி மின்பிரிகை அடைந்து குளோரின் தனியுறுப்புகளை உருவாக்குகிறது. இவ்வுறுப்புகள் உடனடியாக குளோரின் ஓராக்சைடாக மாறுகின்றன. இரண்டு உறுப்புகள் வினைபட்டு இருகுளோரின் ஈராக்சைடு உருவாகி உறுப்பு வினையைத் தடைசெய்யும்வரை இச்சுழற்சி தொடர்கிறது. ஏனெனில் வளிமண்டலத்தில் குளோரோபுளோரோகார்பனின் செறிவு மிகவும் குறைவாகும். அதனால் உறுப்புகளின் வினையைத் தடைசெய்யும் நிகழ்தகவு மிகவும் குறைவு. அதாவது ஒவ்வொரு உறுப்பும் பல்லாயிரக் கணக்கான ஓசோன் மூலக்கூறுகளைச் சிதைக்க முடியும் என்பது இதன் பொருளாகும்.
மேற்கோள்கள்
- Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman (2001). Inorganic chemistry. Academic Press. பக். 462. பன்னாட்டுத் தரப்புத்தக எண்:0-12-352651-5.