பெரிலியம் ஆக்சைடு
பெரிலியம் ஆக்சைடு (Beryllium oxide) என்பது BeO என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். இதை பெரிலியா என்ற பெயராலும் அழைப்பார்கள். இந்த நிறமற்ற திடப்பொருளானது உலோகங்களைக் கடந்து வைரத்தை அடுத்த அதிக வெப்பங் கடத்துத்திறன் கொண்ட ஓர் அலோக மின் கடத்தாப் பொருளாகும்[4]. ஒரு படிக உருவமற்ற திடப்பொருளாக பெரிலியம் ஆக்சைடு வெண்மை நிறத்துடன் காணப்படுகிறது. உயர் உருகுநிலை காரணமாக இது வெப்பமிழக்காப் பொருள் என்ற பயன்பாட்டிற்கு வழியளிக்கிறது. புரோமெல்லைட்டு என்ற கனிமமாக பெரிலியம் ஆக்சைடு இயற்கையில் கிடைக்கிறது. வரலாற்று ரீதியாகவும் பொருள் அறிவியல் துறையிலும் பெரிலியம் ஆக்சைடு குளுசினா அல்லது குளுசினியம் ஆக்சைடு என்ற பெயர்களால் அழைக்கப்படுகிறது.
 | |
 | |
| பெயர்கள் | |
|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
பெரிலியம்(II) மோனாக்சைடு | |
| முறையான ஐயூபிஏசி பெயர்
ஆக்சோபெரிலியம் | |
| வேறு பெயர்கள்
பெரிலியா, தெர்மலாக்சு,புரோமெல்லைட்டு, தெர்மலாக்சு 995.[1] | |
| இனங்காட்டிகள் | |
| 1304-56-9 | |
Beilstein Reference |
3902801 |
| ChEBI | CHEBI:62842 |
| ChemSpider | 14092 |
| EC number | 215-133-1 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image Image |
| ம.பா.த | beryllium+oxide |
| பப்கெம் | 14775 |
| வே.ந.வி.ப எண் | DS4025000 |
SMILES
| |
| UN number | 1566 |
| பண்புகள் | |
| BeO | |
| வாய்ப்பாட்டு எடை | 25.01 g·mol−1 |
| தோற்றம் | நிறமற்றது, பளபளப்பான படிகங்கள் |
| மணம் | நெடியற்றது |
| அடர்த்தி | 3.01 கி/செ.மீ3 |
| உருகுநிலை | |
| கொதிநிலை | 3,900 °C (7,050 °F; 4,170 K) |
| 0.00002 கி/100 மி.லி | |
| Band gap | 10.6 எலக்ட்ரான் வோல்ட்டு |
| வெப்பக் கடத்துத்திறன் | 330 வாட்/(கி•மீ) |
| ஒளிவிலகல் சுட்டெண் (nD) | 1.719 |
| கட்டமைப்பு | |
| படிக அமைப்பு | அறுகோணம் |
| புறவெளித் தொகுதி | P63mc |
| ஒருங்கிணைவு வடிவியல் |
நாற்கோணம் |
| மூலக்கூறு வடிவம் | |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
−599 கி.யூ/மோல் [2] |
| நியம மோலார் எந்திரோப்பி S |
13.73–13.81 யூ/(கி•மோல்) |
| வெப்பக் கொண்மை, C | 25.5 யூ/(கி•மோல்) |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | அதிநச்சு, புற்றுநோய் ஊக்கி |
| GHS pictograms |    |
| GHS signal word | அபாயம் |
| H301, H315, H317, H319, H330, H335, H350, H372 | |
| P201, P260, P280, P284, P301+310, P305+351+338 | |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose) |
2062 மி.கி/மீ (சுண்டெலி, வாய்வழி) |
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |
அனுமதிக்கத்தக்க வரம்பு |
TWA 0.002 மி.கி/மீ3 C 0.005 மி.கி/மீ 3 (30 நிமிடங்கள்), அதிகப்பட்சமாக 0.025 மி.கி/மீ 3 (பெரிலியமாக )[3] |
பரிந்துரைக்கப்பட்ட வரம்பு |
Ca C 0.0005 மி.கி/மீ 3 (பெரிலியமாக )[3] |
உடனடி அபாயம் |
Ca [4 மி.கி/மீ3 (பெரிலியமாக)][3] |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | பெரிலியம் தெலூரைடு |
| ஏனைய நேர் மின்அயனிகள் |
|
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
தயாரிப்பு
பெரிலியம் கார்பனேட்டு உப்பை காற்றில் உயர் வெப்பநிலைக்கு சூடாக்கி அல்லது பெரிலியம் ஐதராக்சைடை நீர் நீக்கம் செய்து அல்லது தனிமநிலை பெரிலியத்தை எரித்து பெரிலியம் ஆக்சைடைத் தயாரிக்கலாம்.
- BeCO3 → BeO + CO2
- Be(OH)2 → BeO + H2O
- 2 Be + O2 → 2 BeO
பெரிலியத்தை காற்றில் எரிக்கும்போது பெரிலியம் ஆக்சைடும் பெரிலியம் நைட்ரைடும் (Be3N2) சேர்ந்த கலவை கிடைக்கிறது[4] . மற்ற காரமண் உலோக ஆக்சைடுகள் போல அல்லாமல் பெரிலியம் ஆக்சைடு காரப்பண்பு மட்டுமில்லாமல் ஈரியல்பு ஆக்சைடாக உருவாகிறது.
வேதிப்பண்புகள்
800 பாகை செல்சியசு வெப்பநிலைக்கு மேலான உயர் வெப்பநிலையில் உருவாகும் உருவாகும் பெரிலியம் ஆக்சைடு மந்த வாயுவாக உள்ளது. ஆனால் சூடான நீரிய அமோனியம் பைபுளோரைடில் (NH4HF2) அல்லது சூடான அடர் கந்தக அமிலகந்தக அமிலக் கரைசலில் (H2SO4) அல்லது அம்மோனியம் சல்பேட்டு ((NH4)2SO4) கரைசலில் நன்கு கரைகிறது.
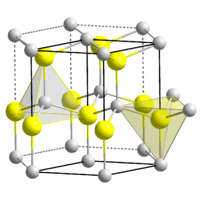
கட்டமைப்பு
அறுகோண உர்ட்சைட்டு கட்டமைப்பில் பெரிலியம் ஆக்சைடு படிகமாகிறது. லான்சுடேலைட்டு கனிமத்திலுள்ளது போல Be2+ மற்றும் O2− நாற்கோண மையங்கள் இக்கட்டமைப்பில் உள்ளன. மாறாக MgO, CaO, SrO, BaO, போன்ற இரண்டாவது தொகுதி ஆக்சைடுகள் கனசதுர பாறை உப்பு நோக்குடன் எண்முக வடிவத்தில் இருநேர்மின் மற்றும் ஈரெதிர்மின் அயனிகளுடன் படிகமாகின்றன[4]. உயர் வெப்பநிலையில் இந்த கட்டமைப்பு நாற்கோண வடிவத்திற்கு மாறுகிறது[5].
நீராவி நிலையில் தனித்தனி மூலக்கூறுகளாக பெரிலியம் ஆக்சைடு உள்ளது. இரண்டு அணுக்கள் மீதும் sp ஆர்பிட்டல் இனக்கலப்பு ஏற்கப்படுகிறது என இணைதிறன் பிணைப்புக் கோட்பாட்டின்படி இதை விவரிக்கமுடியும். இதன்படி ஒவ்வொரு அணுவின் மீதுமுள்ள sp ஆர்பிட்டால்களுக்கு இடையில் ஒரு σ பிணைப்பும் ஒவ்வொரு அணுவிலும் மூலக்கூறு அச்சுக்கு செங்குத்தாக அமைந்திருக்கும் சீரமைக்கப்பட்ட p ஆர்பிட்டால்களுக்கு இடையில் ஒரு π பிணைப்பும் காணப்படுகின்றன. மூலக்கூற்று சுற்றுப்பாதை கோட்பாடு சற்று வேறுபட்ட நிகர சிக்மா பிணைப்பற்ற ஓர் அமைப்பைக் காட்டுகிறது. ஏனெனில் இரண்டு அணுக்களின் 2s ஆர்பிட்டால்களும் இணைந்து முழுமையாக நிரம்பிய சிக்மா பிணைப்பு ஆர்பிட்டாலாகவும் எதிர் சிக்மா பிணைப்பு ஆர்பிட்டாலாகவும் உருவாகின்றன. மேலும் மூலக்கூற்று அச்சுக்கு செங்குத்தாக உள்ள சீரமைக்கப்பட்ட p ஆர்பிட்டால்களுக்கு இடையில் இரண்டு π பிணைப்புகளும் உருவாகின்றன. மூலக்கூற்று அச்சிலுள்ள சீரமைப்பு p ஆர்பிட்டால்களால் உருவாகும் சிக்மா பிணைப்புகள் நிரம்பாமல் உள்ளன. ஒத்த எலக்ட்ரான் C2 மூலக்கூறில் உள்ளது போன்ற (2sσ)2(2sσ*)2(2pπ)4 சீரமைப்பு தொடர்புடைய அடிப்படை ஆற்றல் மட்டமாகும். இங்குள்ள இரண்டு பிணைப்புகளையும் ஆக்சிசனிலிருந்து பெரிலியத்தை நோக்கிய ஈதற் பிணைப்புகளாகக் கருதமுடியும் [6].
பயன்பாடுகள்
உயர்தரமான பெரிலியம் ஆக்சைடு படிகங்களை நீர் வெப்பச் செயல்முறையில் அல்லது வெர்னுவில் முறையால் வளர்க்கலாம். பெரும்பாலும், பெரிலியம் ஆக்சைடு வெள்ளை நிறத்தில் படிக உருவமற்ற தூளாக உற்பத்தி செய்யப்படுகிறது, சூடுபடுத்துவதன் மூலம் தூளை பெரிய வடிவங்களில் உருவாக்கலாம். கார்பன் போன்ற அசுத்தங்கள் நிறமற்ற பெரிலியம் ஆக்சைடு படிகங்களுக்கு பல வண்ணங்களை கொடுக்க முடியும்.
வெப்பச் செயல்முறையில் திடமாக்கப்பட்ட பெரிலியம் ஆக்சைடு மிகவும் நிலையான பீங்கான் ஆகும் [7]. பெரிலியம் ஆக்சைடு ராக்கெட் இயந்திரங்களில் பயன்படுத்தப்படுகிறது [8]. அலுமினிய தொலைநோக்கி கண்ணாடியில் அரிமானத்தை தடுக்கும் மேற்பூச்சாகப் பூசப்படுகிறது. வானொலி உபகரணங்கள் போன்றவற்றில் உயர் செயல்திறன் கொண்ட குறைக்கடத்தி பாகங்களில் பெரிலியம் ஆக்சைடு பயன்படுத்தப்படுகிறது. ஏனெனில் இது நல்ல வெப்ப கடத்துத்திறனைக் கொண்டிருக்கிறது. அதே நேரத்தில் ஒரு நல்ல மின் மின்தேக்கியாகவும் உள்ளது. வெப்பப் பசை போன்ற சில வெப்ப இடைமுகப் பொருட்களில் இது ஓர் இடநிரப்பியாகவும் பயன்படுத்தப்படுகிறது [9]. அலுமினியம் ஆக்சைடைக் காட்டிலும் குறைவான வெப்பத் தடையை அனுமதிக்க பயன்படுத்தும் சில மின்னணு குறைக்கடத்தி சாதனங்களில் உலோக மேற்பொருத்தி தளங்களுக்கும் சிலிக்கான் சில்லுக்கும் இடையில் பெரிலியம் ஆக்சைடு பீங்கான் பயன்படுத்தப்படுகிறது. உயர் செயல்திறன் கொண்ட நுண்ணலை சாதனங்கள், வெற்றிட குழாய்கள், காந்தங்கள் மற்றும் வாயுச் சீரொளி கதிர்கள் போன்றவற்றில் கட்டமைக்கும் பீங்கானாகவும் இது பயன்படுத்தப்படுகிறது. கடற்படையில் கடல் உயர் வெப்பநிலை வாயு-குளிரூட்டப்பட்ட அணு உலைகளுக்கான நியூட்ரான் கட்டுப்படுத்தியாகப் பயன்படுத்த பெரிலியம் ஆக்சைடு முன்மொழியப்பட்டுள்ளது. விண்வெளி பயன்பாடுகளுக்கான நாசாவின் கிலோபவர் அணு உலைக்காகவும் இது முன்மொழியப்பட்டுள்ளது [10].
முன் பாதுகாப்பு
பெரிலியம் ஆக்சைடு படிகவடிவமற்ற தூள் நிலையில் உள்ளபோது ஒரு புற்றுநோய் ஊக்கியாக கருதப்படுகிறது[11] . பெரிலிய நச்சேற்ற நோய்களை உண்டாக்குகிறது. வெப்பச் செயல்முறைக்குப் பின்னர் திடமாக்கப்பட்ட நிலையில் இதைப் பயன்படுத்துவது பாதுகாப்பானதாகும். ஆனால் தூளாக்கும் செயல்முறைகளால் அதை தூசியாக்கக் கூடாது.[12]
மேற்கோள்கள்
- "beryllium oxide – Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information (27 March 2005). பார்த்த நாள் 8 November 2011.
- Zumdahl, Steven S. (2009). Chemical Principles 6th Ed.. Houghton Mifflin Company. பன்னாட்டுத் தரப்புத்தக எண்:0-618-94690-X.
- "NIOSH Pocket Guide to Chemical Hazards #0054". National Institute for Occupational Safety and Health (NIOSH).
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth-Heinemann. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- A. F. Wells (1984). Structural Inorganic Chemistry (5 ). Oxford Science Publications. பன்னாட்டுத் தரப்புத்தக எண்:0-19-855370-6.
- Fundamentals of Spectroscopy. Allied Publishers. பக். 234. பன்னாட்டுத் தரப்புத்தக எண்:978-81-7023-911-6. https://books.google.com/books?id=gfM9B3JshegC&pg=PA234. பார்த்த நாள்: 29 November 2011.
- Günter Petzow, Fritz Aldinger, Sigurd Jönsson, Peter Welge, Vera van Kampen, Thomas Mensing, Thomas Brüning "Beryllium and Beryllium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. எஆசு:10.1002/14356007.a04_011.pub2
- Ropp, Richard C. (2012-12-31) (in en). Encyclopedia of the Alkaline Earth Compounds. Newnes. பன்னாட்டுத் தரப்புத்தக எண்:9780444595539. https://books.google.com/books?id=yZ786vEild0C&pg=PA107&dq=Beryllium+oxide+is+used+in+rocket+engines&hl=en&sa=X&ved=0ahUKEwituojsqdPXAhUF82MKHX8_Bv0Q6AEIKDAA#v=onepage&q=Beryllium%20oxide%20is%20used%20in%20rocket%20engines&f=false.
- Greg Becker; Chris Lee; Zuchen Lin (2005). "Thermal conductivity in advanced chips — Emerging generation of thermal greases offers advantages". Advanced Packaging: 2–4. Archived from the original on June 21, 2000. https://web.archive.org/web/20000621233638/http://www.apmag.com/. பார்த்த நாள்: 2008-03-04.
- McClure, Patrick; Poston, David; Gibson, Marc; Bowman, Cheryl; Creasy, John (14 May 2014). KiloPower Space Reactor Concept – Reactor Materials Study. http://permalink.lanl.gov/object/tr?what=info:lanl-repo/lareport/LA-UR-14-23402. பார்த்த நாள்: 21 November 2017.
- "Hazardous Substance Fact Sheet". New Jersey Department of Health and Senior Services. பார்த்த நாள் August 17, 2018.
- "Beryllium Oxide Safety".