சோடியம் ஆக்சைடு
சோடியம் ஆக்சைடு (Sodium oxide) என்பது Na2O என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். தாது வடிவத்தில் கிடைப்பதில்லை என்றாலும் பீங்கான்கள் மற்றும் கண்ணாடிகளில் பயன்படுத்தப்படுகிறது, சோடியம் ஐதராக்சைடின் அடிப்படை நீரிலி சோடியம் ஆக்சைடு என்பதால் தண்ணீர் சேர்க்கப்பட்டால் NaOH உற்பத்தி செய்யப்படுகிறது.
- Na2O + H2O → 2 NaOH
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
சோடியம் ஆக்சைடு | |||
| வேறு பெயர்கள்
இருசோடியம் ஆக்சைடு | |||
| இனங்காட்டிகள் | |||
| 1313-59-3 | |||
| EC number | 215-208-9 | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 73971 | ||
SMILES
| |||
| UN number | 1825 | ||
| பண்புகள் | |||
| Na2O | |||
| வாய்ப்பாட்டு எடை | 61.98 g·mol−1 | ||
| தோற்றம் | வெண்மையான திண்மம் | ||
| அடர்த்தி | 2.27 கி/செ.மீ3 | ||
| உருகுநிலை | |||
| கொதிநிலை | 1,950 °C (3,540 °F; 2,220 K) | ||
| தீவிர வினையினால் NaOH உருவாகும் | |||
| கரைதிறன் | எத்தனாலுடன் வினைபுரியும் | ||
| கட்டமைப்பு | |||
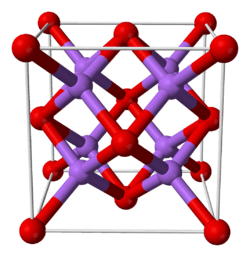
| படிக அமைப்பு | புளோரைட்டு எதிர் (முகமைய கனசதுரம்), cF12 | ||
| புறவெளித் தொகுதி | Fm3m, No. 225 | ||
| ஒருங்கிணைவு வடிவியல் |
நான்முகி (Na+); கனசதுரம் (O2−) | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
-416 கி.யூ/மோல்[1] | ||
| நியம மோலார் எந்திரோப்பி S |
73 யூ/மோல்•கெ[1] | ||
| வெப்பக் கொண்மை, C | 72.95 யூ/மோல்•கெல்வின் | ||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | அரிக்கும், நீருடன் தீவிரமாக வினைபுரியும் | ||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 1653 | ||
| GHS pictograms |  | ||
| H314[2] | |||
| P280[2] | |||
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றாது | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | சோடியம் சல்பைடு சோடியம் செலீனைடு சோடியம் தெலூரைடு | ||
| ஏனைய நேர் மின்அயனிகள் | இலித்தியம் ஆக்சைடு பொட்டாசியம் ஆக்சைடு ருபீடியம் ஆக்சைடு சீசியம் ஆக்சைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
கார உலோக ஆக்சைடுகள் M2O (M = Li, Na, K, RB) போன்ற கார உலோக ஆக்சைடுகள் புளோரைட்டு எதிர் கட்டமைப்பில் படிகமாகின்றன. இந்த நோக்குருவில் எதிர்மின் அயனிகள், நேர்மின் அயனிகளின் இடநிலை அமைப்புகள் தொடர்புடைய CaF2 இல் உள்ள தங்கள் நிலைப்பாடுகளுடன் நேரெதிர் அமைப்பில் படிகமாகியுள்ளன. சோடியம் அயனிகள் நான்கு ஆக்சைடு அயனிகளுடன் நான்முகி வடிவில் ஒருங்கிணைக்கப்பட்டும், எட்டு சோடியம் அயனிகள் ஆக்சைடு கனசதுரத்திலும் ஒருங்கிணைக்கப்பட்டுள்ளன [3][4].
தயாரிப்பு
சோடியத்துடன் சோடியம் ஐதராக்சைடு, சோடியம் பெராக்சைடு அல்லது சோடியம் நைட்ரைட்டு சேர்ந்து வினைபுரிவதால் சோடியம் ஆக்சைடு உருவாகிறது:[5]
- 2 NaOH + 2 Na → 2 Na2O + H2
- Na2O2 + 2 Na → 2 Na2O
- 2 NaNO2 + 6 Na → 4 Na2O + N2
ஐதராக்சைடு, பெராக்சைடு அல்லது நைட்ரைட்டு எதுவாக இருந்தாலும் சோடியத்தினால் ஒடுக்கப்படும் வினைகளாகவே இவ்வினைகள் அமைகின்றன.
காற்றில் எரியும் சோடியம் 20% Na2O மற்றும் 20% சோடியம் பெராக்சைடு, Na2O2. ஆகியனவற்றை உருவாக்குகிறது.
- 6 Na + 2 O2 → 2 Na2O + Na2O2
மாறாக சோடியம் கார்பனேட்டை 851°செல்சியசு வெப்பநிலைக்குச் சூடுபடுத்தினாலும் சோடியம் ஆக்சைடும் கார்பன் டை ஆக்சைடும் உருவாகின்றன.
- Na2CO3 → Na2O + CO2
208°செல்சியசு வெப்பநிலையில் சோடியம் அசுகார்பேட்டு சிதைவடைந்து பியூரான் வழிப்பொருட்களாகவும் சோடியம் ஆக்சைடாகவும் மாறுகிறது.[6]
பயன்பாடுகள்
கண்ணாடி தயாரித்தல்
கண்ணாடிகள் தயாரித்தலில் சோடியம் ஆக்சைடு குறிப்பிடத்தக்க ஒரு பகுதிப்பொருளாக விளங்குகிறது. சோடா எனப்படும் சோடியம் கார்பனேட்டாக இங்கு இது பயன்படுத்தப்படுகிறது. சிக்கலான கூட்டமைப்பு கொண்ட பலபடிகளாக கண்ணாடிகள் காணப்படுவதால் இவற்றில் சோடியம் ஆக்சைடின் இருப்பு வெளிப்படையாகத் தெரிவதில்லை. பேரளவில் தயாரிக்கப்படும் கண்ணாடிகள் 15% சோடியம் ஆக்சைடு, 70% சிலிக்கா (சிலிக்கன் டையாக்சைடு), 9% கால்சியம் ஆக்சைடுகளைக் கொண்டுள்ளன. சிலிக்கா உருகும்போது அதன் வெப்பநிலையை குறைக்கும் ஓர் இளக்கியாக சோடியம் கார்பனேட்டு பயன்படுகிறது. தூய்மையான சிலிக்காவைக் காட்டிலும் சோடா கண்ணாடி மிகக்குறைந்த வெப்பநிலையையும் சற்று இழுவைத்தன்மையையும் கொண்டுள்ளது. சிலிக்கன் டையாக்சைடும் சோடியம் கார்பனேட்டும் வினைபுரிந்து சோடியம் சிலிக்கேட்டுகளாக Na2[SiO2]x[SiO3]. என்ற பொதுவாய்ப்பாட்டுடன் உருவாவதால் இம்மாற்றங்கள் நிகழ்கின்றன.
- Na2CO3 → Na2O + CO2
- Na2O + SiO2 → Na2SiO3.
மேற்கோள்கள்
- Zumdahl, Steven S. (2009). Chemical Principles 6th Ed.. Houghton Mifflin Company. பக். A23. பன்னாட்டுத் தரப்புத்தக எண்:0-618-94690-X.
- Sigma-Aldrich Co., Sodium oxide. Retrieved on 2014-05-25.
- Eduard Zintl; Harder, A.; Dauth B. (1934). "Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums". Z. Elektrochem. Angew. Phys. Chem. 40: 588–93.
- Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth–Heinemann. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- பப்கெம் Sodium Ascorbate