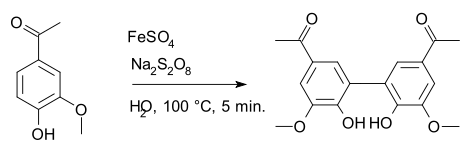சோடியம் பெர்சல்பேட்டு
சோடியம் பெர்சல்பேட்டு (Sodium persulfate) என்பது Na2S2O8 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். பெராக்சிடைகந்தக அமிலத்தினுடைய (H2S2O8) சோடியம் உப்பு சோடியம் பெர்சல்பேட்டு ஆகும். வெண்மை நிறத்தில் திண்மமாக காணப்படும் இச்சேர்மம் ஓர் ஆக்சிசனேற்ற முகவராகும். சோடியம் பெர்சல்பேட்டு தண்ணீரில் கரைகிறது. கிட்டத்தட்ட நீருறிஞ்சா பண்புடன் நிலைப்புத்தன்மை கொண்ட சேர்மமாக இது காணப்படுகிறது.
 | |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
சோடியம் பெராக்சோடைசல்பேட்டு சோடியம் பெராக்சிடைசல்பேட்டு | |
| இனங்காட்டிகள் | |
| 7775-27-1 | |
| ChEMBL | ChEMBL502764 |
| ChemSpider | 56406 |
| EC number | 231-892-1 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 62655 |
| வே.ந.வி.ப எண் | SE0525000 |
SMILES
| |
| UN number | 1505 |
| பண்புகள் | |
| Na2S2O8 | |
| வாய்ப்பாட்டு எடை | 238.10 கி/மோல் |
| தோற்றம் | வெண் தூள் |
| அடர்த்தி | 2.59 கி/செ.மீ/3 (Loose bulk density: 1.12 கி/செ.மீ3)[1] |
| உருகுநிலை | |
| 55.6 கி/100 மி.லி (20 °செ) | |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 1136 |
| GHS pictograms |    |
| GHS signal word | அபாயம் |
| H272, H302, H315, H317, H319, H334, H335, H371 | |
| P220, P261, P280, P305+351+338, P342+311 | |
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றாது |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | சோடியம் டைதயோனைட்டு Sodium sulfite சோடியம் சல்பேட்டு |
| ஏனைய நேர் மின்அயனிகள் | பொட்டாசியம் பெர்சல்பேட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
தயாரிப்பு முறை
சோடியம் ஐதரசன் சல்பேட்டை மின்னாற்பகுப்பு ஆக்சிசனேற்றம் செய்து இவ்வுப்பு தயாரிக்கப்படுகிறது.
- 2 NaHSO4 → Na2S2O8 + H2
பிளாட்டினம் நேர்மின் வாயில் இந்த ஆக்சிசனேற்றம் நிகழ்கிறது.[2] இவ்வழிமுறையில் 2005 ஆம் ஆண்டில் மட்டும் 165,000 டன்கள் உற்பத்தி செய்யப்பட்டுள்ளது.[3] சோடியம் பெர்சல்பேட்டிலிருந்து ஐதரசன் சல்பேட்டாக மாறும் வினையின் ஏற்ற இறக்க செயல்திறன் 2.1 வோல்ட்டு ஆகும். இந்த அளவு ஐதரசன் பெராக்சைடின் செயல்திறனைக் (1.8 வோல்ட்டு) காட்டிலும் அதிகமாகும். ஆனால் ஓசோனைக்காட்டிலும் (2.2 வோல்ட்டு) குறைவாகும் [4]. தளத்தில் உருவாகும் சல்பேட்டு தனியுறுப்பின் மின் திறன் 2.7 வோல்ட்டு ஆகும். பிளாட்டினம் நேர்மின் வாயைப் பயன்படுத்தி உப்புகளை உற்பத்தி செய்வதில் சில இடையூறுகளும் ஏற்படுகின்றன. ஆக்சிசன் வெளியேறுவதால் இச்செயல்முறையானது திறனற்ற செயல்முறையாகக் கருதப்படுகிறது. விளைபொருளில் பிளாட்டினம் அரிமானத்தால் தோன்றும் மாசுக்கள் கலந்துவிடுகின்றன. எனவே போரான் கலப்பு வைர மின்வாய்கள் மரபார்ந்த பிளாட்டினம் மின்வாய்களுக்கு மாற்றாக மாற்று மின்வாய்களாகப் பயன்படுத்த பரிந்துரைக்கப்படுகின்றன[5].
பயன்பாடுகள்
அக்ரைலோநைட்ரைல் பியூட்டாடையீன் சிடைரீன் போன்ற சிடைரீன் அடிப்படையிலான பலபடிகளுக்குரிய பால்ம பலபடியாக்கல் வினைகளுக்குத் தேவையான தனியுறுப்பு தொடக்கப் பொருளாக இது பயன்படுத்தப்படுகிறது. மேலும் இது பார்மால்டிகைடு பசைகளில் ஈரமாற்றலுக்கும் பயனுள்ளதாக உள்ளது.
பிற பயன்கள்
முடி அலங்காரப் பொருட்களில் வெளுப்பாக்கியாகவும் அழுக்கு நீக்கிகளின் பகுதிக்கூறாகவும் சோடியம் பெர்சல்பேட்டு பயன்படுத்தப்படுகிறது. துத்தநாகம் மற்றும் மின்சுற்றுப் பலகைகள் செதுக்கும் கலவைகளில் பயன்படும் அமோனியம் பெர்சல்பேட்டுக்குப் பதிலாக இதைப் பயன்படுத்துகிறார்கள். தாமிரம் மற்றும் சில வேதிப்பொருட்களை தூய்மையாக்கும் செயல் முறைகளிலும் இதைப் பயன்படுத்துகிறார்கள். மண்ணை பாங்கு படுத்தும் ஒரு வேதிப்பொருளாகவும், மண் மற்றும் நிலத்தடி நீரை சீராக்கும் பொருளாகவும் இதைப் பயன்படுத்துகிறார்கள். சாயங்களை பேரளவில் தயாரிக்கவும், மாவுப் பொருள்களை வெளிறச் செய்யும் செயலூக்கிகளை திருத்தவும், நெசவுத் தொழிலில் கஞ்சிநீக்கம் செய்யவும் பயன்படுகிறது.
கரிம வேதியியல் பயன்
சோடியம் பெர்சல்பேட்டு ஆக்சிசனேற்றும் முகவராக வேதியியலில் பயன்படுத்தப்படுகிறது. குறிப்பாக எல்ப்சு பெர்சல்பேட்டு ஆக்சிசனேற்றம் மற்றும் பாய்லேண்டு-சிம்சு ஆக்சிசனேற்ற வினைகள் சில உதாரணங்களாகும். இரும்பு(II)சல்பேட்டை தனியுறுப்பு தொடக்கப் பொருளாகப் பயன்படுத்தி அப்போசயனின் சேர்மத்திலிருந்து டையப்போசயனினாக தொகுக்கும் தொகுப்பு வினையிலும் இச்சேர்மம் பயன்படுகிறது [6].
தற்காப்பு
இதுவோர் ஆக்சிகரணியாக இருப்பதால் காகிதம் போன்ற கரிமச் சேர்மங்களுடன் சேர்ந்து எளிதில் எரியக்கூடிய பொருளாக உருவாகிறது.
மேற்கோள்கள்
- FMC Corporation. Sodium Persulfate. "Archived copy". மூல முகவரியிலிருந்து 2011-11-21 அன்று பரணிடப்பட்டது. பார்த்த நாள் 2013-11-17. (accessed Nov 17, 2013).
- Pietzsch, A.; Adolph, G. J. Chem. Technol. Biotechnol. 1911, 30, 85.
- Harald Jakob, Stefan Leininger, Thomas Lehmann, Sylvia Jacobi, Sven Gutewort (2005), "Peroxo Compounds, Inorganic", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a19_177.pub2
- Block, Philip A., Richard A. Brown, and David Robinson. "Novel activation technologies for sodium persulfate in situ chemical oxidation." Proceedings of the Fourth International Conference on the remediation of chlorinated and recalcitrant compounds. 2004.
- Shafiee, Saiful Arifin; Aarons, Jolyon; Hairul Hisham, Hamzah (2018). "Electroreduction of Peroxodisulfate: A Review of a Complicated Reaction". Journal of The Electrochemical Society (ECS) 165 (13): H785-H798. doi:10.1149/2.1161811jes. http://m.jes.ecsdl.org/content/165/13/H785.abstract?sid=3ddef67b-7f3b-49fa-93a7-c6eee812bfe4.
- Luchtefeld, Ron; Dasari, Mina S.; Richards, Kristy M.; Alt, Mikaela L.; Crawford, Clark F. P.; Schleiden, Amanda; Ingram, Jai; Hamidou, Abdel Aziz Amadou et al. (2008). "Synthesis of Diapocynin". J. Chem. Educ. 85 (3): 411. doi:10.1021/ed085p411.