அலுமினியம் நைட்ரேட்டு
அலுமினியம் நைட்ரேட்டு (Aluminium nitrate) என்பது Al(NO3)3 என்ற மூலக்கூறு வாய்பாட்டைக் கொண்ட சேர்மமாகும். இது அலுமினியமும் நைட்ரிக் காடியும் சேர்ந்த ஓர் அலுமினிய உப்பு. பொதுவாக, இது படிக நீரேறியாகவும், பரவலாக அலுமினியம் நைட்ரேட்டு நோனாஐதரேட்டு (Al(NO3)3·9H2O) ஆகவும் காணப்படுகிறது.
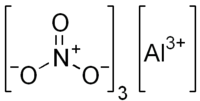 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
அலுமினியம் நைட்ரேட்டு | |
| வேறு பெயர்கள்
நைட்ரிக் அமிலம், அலுமினியம் உப்பு அலுமினியம் நைட்ரேட்டு அலுமினியம் (III) நைட்ரேட்டு | |
| இனங்காட்டிகள் | |
| 13473-90-0 | |
| ChemSpider | 24267 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 26053 |
| வே.ந.வி.ப எண் | BD1040000 (anhydrous) BD1050000 (nonahydrate) |
SMILES
| |
| பண்புகள் | |
| Al(NO3)3 | |
| வாய்ப்பாட்டு எடை | 212.996 g/mol (anhydrous) 375.134 g/mol (nonahydrate) |
| தோற்றம் | வெண்படிகங்கள், திடப்பொருள் நீருறிஞ்சி |
| மணம் | நெடியற்றது |
| அடர்த்தி | 1.72 கி/செமீ3 (nonahydrate) |
| உருகுநிலை | |
| கொதிநிலை | 150 °C (302 °F; 423 K) |
| நீரற்றது: 60.0 கி/100மிலீ (0°செ) 73.9 கி/100மிலீ (20 °செ) 160 கி/100மிலீ (100 °செ) நோனாஐதரேட்டு: 67.3 கி/100 மிலீ | |
| [[மெத்தனால்]]-இல் கரைதிறன் | 14.45 கி/மிலீ |
| [[எத்தனால்]]-இல் கரைதிறன் | 8.63 கி/100மிலீ |
| [[எத்திலீன் கிளைக்கால்]]-இல் கரைதிறன் | 18.32 கி/100மிலீ |
| ஒளிவிலகல் சுட்டெண் (nD) | 1.54 |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | External MSDS |
| தீப்பற்றும் வெப்பநிலை | 35 °C (95 °F; 308 K) (நோனாஐதரேட்டு) |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose) |
4280 மிகி/கிகி, oral (rat) |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
தயாரிப்பு
வினை நடைபெறும் போது, அலுமினியம் வினை முடக்கும் அடுக்காக உருவாவதால் இதை நைட்ரிக் காடியுடன் சேர்த்து எளிதாக அலுமினியம் நைட்ரேட்டு தயாரிக்க இயல்வதில்லை.
எனவே நைட்ரிக் காடியை அலுமினியம் முக்குளோரைடுடன் சேர்த்து வினையை நிகழ்த்துகிறார்கள். நைட்ரோசில் குளோரைடு உடன் விளைப் பொருளாக உருவாகி கரைசலில் இருந்து குமிழ்களாக வெளியேறுகிறது.
இவ்வாறே காரீய நைட்ரேட்டு கரைசலை அலுமினியம் சல்பேட்டு கரைசலுடன் சேர்த்து அலுமினியம் நைட்ரேட்டு ஒன்பதாம் நீரேறியையும் தயாரிக்க இயலும். கரையாத காரீய சல்பேட்டு வீழ்படிவு கரைசலில் இருந்து பிரிக்கப்பட்டவுடன் அலுமினியம் நைட்ரேட்டு கரைசல் எஞ்சுகிறது.
அலுமினியம் சல்பேட்டு கரைசலுடன் கால்சியம் நைட்ரேட்டு கரைசலை கலந்தும் அலுமினியம் நைட்ரேட்டு ஒன்பதாம் நீரேறியைத் தயாரிக்க முடியும். கரையாத கால்சியம் சல்பேட்டு வீழ்படிவு கரைசலில் இருந்து பிரிக்கப்பட்டவுடன் படிகமாக்கல் முறையில் அலுமினியம் நைட்ரேட்டு ஒன்பதாம் நீரேறியை தூய்மைப் படுத்திக் கொள்ளலாம்.
பிற நேர்மின் அயனிகளான பேரியம், துரந்தியம், வெள்ளி போன்ற தனிமங்களும் அலுமினியம் நைட்ரேட்டு ஒன்பதாம் நீரேறியைத் தயாரிக்கப் பயன்படுத்துகிறார்கள். ஏனெனில், அவற்றின் சல்பேட்டு உப்புகளும் கரைவதில்லை.
பயன்கள்
அலுமினியம் நைட்ரேட்டு ஒரு வலிமையான ஆக்சிசனேற்றியாகும். தோல் பதனிடுதல், நாற்றம் நீக்குதல், அரிப்பி ஒடுக்குதல், யுரேனியம் பிரித்தெடுத்தல், பெட்ரோலிய சுத்திகரிப்பு மற்றும் நைட்ரசனேற்றி என பல்வேறு வகைகளில் இது பயன்படுகிறது.
அலுமினியம் நைட்ரேட்டு ஒன்பதாம் நீரேறி தவிர மற்ற அலுமினியம் நைட்ரேட்டின் நீரேறிகளும் பல பயன்களைத் தருகின்றன. இவற்றின் உப்புகள் அலுமினா தயாரிக்கப் பயன்படுகின்றன. காப்பிடும் காகிதம், எதிர்முனைக் கதிர்க்குழாயில் சூடேற்றும் மூலகம் மற்றும் மின்மாற்று உள்ளகங்களின் மேல்தகடுகள் தயாரிக்க அலுமினா உதவுகிறது. இவற்றின் நீரேறி உப்புகள் ஆக்டினைடு தனிமங்கள் பிரித்தெடுப்பதிலும் பயன்படுகின்றன.
ஆய்வகங்களிலும் வகுப்பறைகளிலும் பின்வரும் வேதிவினை நிகழ்த்த அலுமினியம் நைட்ரேட்டு பயன்படுகிறது.
- Al(NO3)3 + 3NaOH → Al(OH)3 + 3NaNO3
மேற்கோள்கள்
வெளியிணைப்புக்கள்
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 |
C | NO− 3, NH4NO3 |
O | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)3, Fe(NO3)2 |
Co(NO3)2, Co(NO3)3 |
Ni(NO3)2 | Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | Br | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru | Rh | Pd(NO3)2 | AgNO3 | Cd(NO3)2 | In | Sn | Sb(NO3)3 | Te | I | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2(NO3)2, Hg(NO3)2 |
Tl(NO3)3, TlNO3 |
Pb(NO3)2 | Bi(NO3)3 BiO(NO3) |
Po | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3, Ce(NO3)4 |
Pr | Nd(NO3)3 | Pm | Sm | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy | Ho | Er | Tm | Yb | Lu | |||
| Ac(NO3)3 | Th(NO3)4 | Pa | UO2(NO3)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||