அலுமினியம் பாசுபைடு
அலுமினியம் பாசுபைடு (Aluminium phosphide) ஒரு கடுமையான நச்சுத்தன்மை கொண்ட கனிமச் சேர்மம் ஆகும். இந்தச் சேர்மமானது குறைக்கடத்தியாகவும், புகையூட்டியாகவும் பயன்படுத்தப்படுகிறது.
 | |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
அலுமினியம் பாசுபைடு அலுமினியம்(III) பாசுபைடு அலுமினியம் மோனோபாசுபைடு பாஸ்டாக்சின் பியூமிடாக்சின் | |
| இனங்காட்டிகள் | |
| 20859-73-8 | |
| ChemSpider | 28171 |
| EC number | 244-088-0 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 30332 |
| வே.ந.வி.ப எண் | BD1400000 |
SMILES
| |
| UNII | E23DR6L59S |
| பண்புகள் | |
| AlP | |
| வாய்ப்பாட்டு எடை | 57.9552 கி/மோல் |
| தோற்றம் | மஞ்சள் அல்லது சாம்பல் நிற படிகங்கள் |
| மணம் | பூண்டு மணம் |
| அடர்த்தி | 2.85 கி/செமீ3 |
| உருகுநிலை | |
| வினைபுரிகிறது | |
| Band gap | 2.5 eV (indirect)[1] |
| ஒளிவிலகல் சுட்டெண் (nD) | 2.75 (IR), ~3 (Vis) [1] |
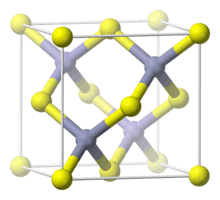
| கட்டமைப்பு | |
| படிக அமைப்பு | சிங்க் பிளெண்ட்டு |
| புறவெளித் தொகுதி | T2d-F43m |
| Lattice constant | a = 546.35 பிகோமீட்டர் |
| ஒருங்கிணைவு வடிவியல் |
நான்முகி |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-164.4 கிலோயூல்/மோல் |
| நியம மோலார் எந்திரோப்பி S |
47.3 யூல்/மோல் கெல்வின் |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | External MSDS |
| ஈயூ வகைப்பாடு | |
| தீப்பற்றும் வெப்பநிலை | > 800 °C (1,470 °F; 1,070 K) |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose) |
11.5 மிகி/கிகி |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
இந்த நிறமற்ற திண்மமானது, நீராற்பகுத்தல் மற்றும் ஒடுக்க-ஏற்ற வேதிவினைகளின் விளைவாக, இச்சேர்மத்தில் கலந்துள்ள மாசுகளின் காரணமாக, பொதுவாக, சாம்பல்-பச்சை-மஞ்சள் துாளாக விற்பனை செய்யப்படுகிறது.
பண்புகள்
AlP படிகங்கள் அடர் சாம்பல் முதல் அடர் மஞ்சள் வரையிலான நிறத்தையும், துத்தநாக சல்பைடின் கனசதுர படிக அமைப்பையும் கொண்டுள்ளது.[2] 300 கெல்வின் வெப்பநிலையில்இதன் படிகக்கூடு மாறிலியானது 5.4510 Å ஆக உள்ளது.[3] இவை 1,000 °C (1,830 °F) வரையிலான வெப்பநிலையில் வெப்பஇயக்கவியல்ரீதியிலான நிலைத்தன்மையைப் பெற்றவையாகும்.
அலுமினியம் பாசுபைடு நீர் அல்லது அமிலங்களுடன் 1,000 °C (1,830 °F) வெப்பநிலையில் பாஸ்பீன்களை வெளியிடுகின்றன.
- AlP + 3 H2O → Al(OH)3 + PH3
- AlP + 3 H+ → Al3+ + PH3
தயாரிப்பு
அலுமினியம் பாசுபைடானது அதன் தனிமங்களின் சேர்க்கையினால் தொகுக்கப்படுகிறது:[4][5]
- 4Al + P4 → 4AlP
நீருடன் வினைபுரிந்தால் நச்சுத்தன்மையுள்ள பாஸ்பீன் வாயு வெளியேறக்கூடிய வாய்ப்பு உள்ளதால்,ஈரப்பதமான சூழ்நிலைகளில் அலுமினியம் பாசுபைடை திறந்த நிலையில் வைப்பதைத் தவிர்க்கும் வகையில் முன்னெச்சரிக்கையும், கவனமும் செலுத்தப்பட வேண்டும்.
பயன்கள்
தீங்குயிர்க்கொல்லி
AlP தானிய மணிகளைப் பாதுகாப்பதில் கொறிணி கொல்லி, பூச்சிக்கொல்லி, மற்றும் புகையூட்டி எனப் பலவகையாகப் பயன்படுகிறது. இது சுண்டெலி, பெருச்சாளி போன்ற பாலூட்டிகளைக் கொல்லவும் பயன்படுத்தப்படுகிறது. கோதுமை மாத்திரை எனப்படும் மாத்திரைகள் அமோனியாவை வெளியிடும் சில வேதிப்பொருட்களையும் கொண்டிருக்கும். இந்த அம்மோனியா பாஸ்பீன் வாயுவின் தன்னிச்சையான எரிதல் அல்லது வெடித்தலைத் தடுப்பதற்கு உதவுகிறது. AlP யானது புகையூட்டியகாவும் மற்றும் வாய்வழி உயிர்க்கொல்லியாகவும் பயன்படுகிறது. கொறிணி கொல்லியாக, அலுமினியம் பாசுபைடு மாத்திரைகள் உணவுடன் கலந்து கொறிணிகள் உண்பதற்காக வைக்கப்படுகின்றது. கொறிணியின் செரிமான மண்டலத்தில் அமிலமானது, பாசுபைடுடன் வினைபுரிந்து நச்சுத்தன்மையுள்ள பாஸ்பீன் வாயுவை வெளியிடுகின்றது. துத்தநாக பாசுபைடு மற்றும் கால்சியம் பாசுபைடு ஆகியவை அலுமினியம் பாசுபைடினைப் போன்ற மற்ற தீங்குயிர் கொல்லிகள் ஆகும். அலுமினியம் பாசுபைடானது பாசுபீன் வாயுவைப் பின்வரும் நீராற்பகுத்தல் வினையின்படி வெளியிடுகிறது. [5]
- 2 AlP + 6 H2O → Al2O3∙3 H2O + 2 PH3
இதர தீங்குயிர்க்கொல்லி பயன்பாடுகள் நடைமுறைக்கு சரிப்பட்டு வராமல் இருந்தால் இது புகையூட்டியாகப் பயன்படுகிறது. கப்பல்கள், விமானம் மற்றும் தானிய குதிர்கள் போன்ற கட்டமைப்புகளின் நிர்மாணத்தின்போதும் இது பயன்படுத்தப்படுகிறது. இத்தகைய அனைத்து கட்டுமான அமைப்புகளும் பாஸ்பீன் புகையைக் கொண்டிருக்கும் போதும், அதன் செறிவை அதிகரிக்கும்போதும், திறம்பட வாயுக்கள் புகாத அளவுக்கு இறுக்கமாக மூடப்பட்டிருக்க வேண்டும். புகையூட்டிகள் நேரடியாகவும் கொறிணிகளின் வலைக்குள் செலுத்தப்படுவதுண்டு.
குறைக்கடத்தி பயன்பாடுகள்
தொழிற்துறையில், AlP ஒரு குறைக்கடத்திப் பொருளாகப் பயன்படுத்தப்படுகிறது. இதற்காக இது வழக்கமாக மற்ற ஈருறுப்பு உலோகங்களுடன் உலோகக்கலவையாக மாற்றப்பட்டு பயன்படுத்தப்படுகுிறது. இவ்வாறு தயாரிக்கப்பட்ட உலோகக்கலவையானது ஒளி உமிழ் இருமுனையங்கள் போன்ற சாதனங்களின் பயன்பாடுகளில் உபயோகப்படுத்தப்படுகின்றன. [6]
மேற்கோள்கள்
- Berger, L. I. (1996). Semiconductor Materials. CRC Press. பக். 125. பன்னாட்டுத் தரப்புத்தக எண்:0-8493-8912-7.
- Van Zeghbroeck (1997). "Bravais Lattices; Zincblende Lattice". University of Colorado.
- "Lattice Constants". SiliconFarEast.com (2004). பார்த்த நாள் 3 January 2017.
- White, W. E.; Bushey, A. H.; Holtzclaw, H. F.; Hengeveld, F. W. (1953). Bailar, J. C.. ed. "Aluminum Phosphide". Inorganic Syntheses. Inorganic Syntheses 4: 23–25. doi:10.1002/9780470132357.ch7. பன்னாட்டுத் தரப்புத்தக எண்:978-0-470-13235-7.
- White, W. E.; Bushey, A. H. (1944). "Aluminum Phosphide – Preparation and Composition". Journal of the American Chemical Society 66 (10): 1666. doi:10.1021/ja01238a018.
- Corbridge, D. E. C. (1995). Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology (5th ). Amsterdam: Elsevier. பன்னாட்டுத் தரப்புத்தக எண்:0-444-89307-5.