புரோமின் முப்புளோரைடு
புரோமின் முப்புளோரைடு (Bromine trifluoride) என்பது BrF3 என்ற மூலக்கூறு வாய்பாடு கொண்ட ஒரு உப்பீனியிடைச் சேர்மமாகும். வைக்கோல் நிறம் கொண்ட இத்திரவம் காரநெடியுடையது ஆகும்.[4] இது கந்தக அமிலத்தில் கரையும் அதே நேரத்தில் தண்ணீருடனும் கரிமச் சேர்மங்களுடனும் தொடர்பு கொண்டால் வெடிக்கும் தன்மை கொண்டுள்ளது. இது ஒரு சக்திவாய்ந்த புளோரினேற்றும் முகவராகவும் அயனியாக்கும் கனிம கரைப்பானாகவும் இருக்கிறது. யுரேனியம் அறுமபுளோரைடு ((UF6)) உற்பத்தி செய்வதில் அணு எரிபொருளை பதப்படுத்தல் , மறு பதப்படுத்தல் ஆகிய செயல்முறைகளில் பயன்படுத்தப்படுகிறது.[5]
 | |
 | |
| பண்புகள் | |
|---|---|
| BrF3 | |
| வாய்ப்பாட்டு எடை | 136.90 கி/மோல் |
| தோற்றம் | வைக்கோல் நிற திரவம் நீருறிஞ்சி |
| மணம் | கார நெடியுடையது[1] |
| அடர்த்தி | 2.803 கி/செ.மீ3 [2] |
| உருகுநிலை | |
| கொதிநிலை | 125.72 °C (258.30 °F; 398.87 K) |
| வேகமாக சிதைவடைகிறது [3] | |
| கந்தக அமிலம்-இல் கரைதிறன் | நன்றாக கரையும் |
| கட்டமைப்பு | |
| மூலக்கூறு வடிவம் | |
| இருமுனைத் திருப்புமை (Dipole moment) | 1.19 D |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | நீருடன் தொடர்பு அபாயகரமானது.HF உற்பத்திக்கான மூலப்பொருள் |
| ஈயூ வகைப்பாடு | |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | புரோமின் ஒற்றை குளோரைடு |
| ஏனைய நேர் மின்அயனிகள் | குளோரின் முப்புளோரைடு அயோடின் முப்புளோரைடு |
| தொடர்புடைய சேர்மங்கள் | புரோமின் ஒற்றை புளோரைடு புரோமின் ஐம்புளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
தொகுப்பு முறையில் தயாரித்தல்
1906 ஆம் ஆண்டு பவுல் இலெபூ புளோரினுடன் புரோமினைச் 20 பாகை செல்சியசு [6] வெப்பநிலையில் சேர்த்து முப்புளோரைடை தொகுப்பு முறையில் தயாரித்தார்.
- Br2 + 3 F2 → 2 BrF3
புரோமின் ஒற்றைபுளோரைடு விகிதச்சமமாதலின்மை அடைந்து புரோமின் முப்புளோரைடைக் கொடுக்கிறது.:[4]
- 3 BrF → BrF3 + Br2
அமைப்பு
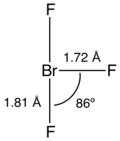
ClF3 மற்றும் IF3 போல்வே புரோமின் முப்புளோரைடும் ஆங்கில எழுத்து T வடிவம் கொண்டுள்ளது. வலுவளவு ஓட்டு இலத்திரன் சோடிகளின் தள்ளுகைக் கொள்கை உருவவியலின் படி புரோமின் மையம் இரண்டு எலக்ட்ரான் சோடிகளாக கருதப்படுகிறது. புரோமினில் இருந்து ஒவ்வொரு அச்சுவழி புளோரினும் 1.81 Å தொலைவிலும் நடுவரை புளோரினில் இருந்து 1.72 Å தொலைவிலும் காணப்படுகின்றன. அச்சுவழி புளோரினுக்கும் நடுவரை புளோரினுக்கும் இடையே உள்ள கோணம் 90 பாகையை விட குறைவாக 86.2 பாகையாக உள்ளது. ஏனெனில் எலக்ட்ரான் இணைகள் உற்பத்தி செய்யும் எதிர்ப்பு புரோமின் – புளோரின் பிணைப்பு விசையை விட அதிகமாக உள்ளது.[7][8]
வேதிப்பண்புகள்
புரோமின் முப்புளோரைடு ஒரு புளோரினேற்றும் முகவராகச் செயல்படுகிறது. ஆனால் குளோரோ புளோரைடைவிட குறைவான வினைத்திறன் கொண்டுள்ளது. இத்திரவம் கடத்தியாகவும் தன்னயனியாதலுக்கு காரணமாகவும் இருக்கிறது.:[5]
- 2 BrF3 ⇌ BrF2+ + BrF4−
அயனபுளோரைடுகளில் பல எளிதாக புரோமின் முப்புளோரைடில் கரைகின்றன. இதனால் புளோரோ எதிர்மின் அயனிகள் தோன்றுகின்றன.
- KF + BrF3 → KBrF4
மேற்கோள்கள்
- http://www.chammascutters.com/en/downloads/Bromine-Trifluoride-MSDS.pdf
- Lide, David R., தொகுப்பாசிரியர் (2006). CRC Handbook of Chemistry and Physics (87th ). Boca Raton, FL: CRC Press. பன்னாட்டுத் தரப்புத்தக எண்:0-8493-0487-3.
- http://www.mathesongas.com/pdfs/msds/MAT03380.pdf
- Simons JH (1950). "Bromine (III) Fluoride - Bromine Trifluoride". Inorganic Synthesis. Inorganic Syntheses 3: 184–186. doi:10.1002/9780470132340.ch48. பன்னாட்டுத் தரப்புத்தக எண்:978-0-470-13234-0.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth-Heinemann. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- Lebeau P. (1906). "The effect of fluorine on chloride and on bromine". Annales de Chimie et de Physique 9: 241–263.
- Gutmann V (1950). "Die Chemie in Bromtrifuoride". Angewante Chemie 62 (13–14): 312–315. doi:10.1002/ange.19500621305.
- Meinert H (1967). "Interhalogenverbindungen". Zeitschrift für Chemie 7: 41.