துத்தநாக நைட்ரேட்டு
துத்தநாக நைட்ரேட்டு (Zinc nitrate) என்பது Zn(NO3)2 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். வெண்மை நிறத்திலுள்ள இப்படிகத் திண்மம் ஈரமுறிஞ்சியாகவும் அறுநீரேற்றாகவும் (Zn(NO3)2•6H2O) காணப்படுகிறது. ஆல்ககால் மற்றும் நீர் ஆகிய இரண்டிலும் இது கரைகின்றது.
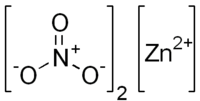 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
துத்தநாக நைட்ரேட்டு | |
| இனங்காட்டிகள் | |
| 7779-88-6 19154-63-3 (நான்குநீரேற்று) 10196-18-6 (அறுநீரேற்று) | |
| ChemSpider | 22926 |
| EC number | 231-943-8 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24518 |
| வே.ந.வி.ப எண் | ZH4772000 |
SMILES
| |
| UN number | 1514 |
| பண்புகள் | |
| Zn(NO3)2 | |
| வாய்ப்பாட்டு எடை | 189.36 கி/மோல் (நீரிலி) 297.49 கி/மோல் (அறுநீரேற்று) |
| தோற்றம் | நிறமற்றது, ஈரமுறிஞ்சி படிகங்கள் |
| அடர்த்தி | 2.065 கி/செ.மீ3 (அறுநீரேற்று) |
| உருகுநிலை | |
| கொதிநிலை | ~ 125 °C (257 °F; 398 K) சிதைவடையும் (அறுநீரேற்று) |
| 327 கி/100 மி.லி, 40 °செ (மூவைதரேட்டு) 184.3 கி/100 மி.லி, 20 °செ (அறுநீரேற்று) | |
| கரைதிறன் | ஆல்ககாலில் நன்றாகக் கரையும். |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | ஆக்சிசனேற்றி சூடுபடுத்தும் பொழுது வெடிக்கலாம் |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 1206 |
| தீப்பற்றும் வெப்பநிலை | எளிதில் தீப்பற்றாது |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | துத்தநாக சல்பேட்டு துத்தநாகக் குளோரைடு |
| ஏனைய நேர் மின்அயனிகள் | காட்மியம் நைட்ரேட்டு பாதரசம்(II) நைட்ரேட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
தயாரிப்பு மற்றும் வினைகள்
பொதுவாக துத்தநாகத்தை நைட்ரிக் அமிலத்தில் கரைத்து துத்தநாக நைட்ரேட்டு தயாரிக்கப்படுகிறது. இவ்வினை நைட்ரிக் அமிலத்தின் அடர்த்தியை அடிப்படையாகக் கொண்டது ஆகும். அடர் அமிலத்தைப் பயன்படுத்தினால் அமோனியம் நைட்ரேட்டு உருவாகிறது.
- Zn + 2 HNO3 (நீர்த்த அமிலம்) → Zn(NO3)2 + H2
- 4 Zn + 10 HNO3 (அடர் அமிலம்) → 4 Zn(NO3)2 + NH4NO3 + 3 H2O
சூடுபடுத்தும் பொழுது, துத்தநாக நைட்ரேட்டு வெப்பசிதைவுக்கு உட்பட்டு துத்தநாக ஆக்சைடு, நைட்ரசன் ஈராக்சைடு மற்றும் ஆக்சிசன் முதலியனவாகச் சிதைகிறது.
2 Zn(NO3)2 → 2 ZnO + 4 NO2 + O2
பயன்கள்
பெருமளவு அடிப்படையிலான பயன்கள் ஏதுமில்லை எனினும் துத்தநாக நைட்ரேட்டு ஆய்வகங்களில் ஒருங்கிணைப்புப் பல்லுறுப்பிகள் தயாரிப்பில் பயன்படுத்தப்படுகிறது[1]. கட்டுப்படுத்தப்பட்ட சிதைவு மூலம் தயாரிக்கப்படும் துத்தநாக ஆக்சைடு , மீநுண் கம்பிகள் உள்ளிட்ட பல்வேறு துத்தநாக ஆக்சைடுகள் அடிப்படையிலான அமைப்புகள் தயாரிக்கப் பயன்படுகின்றன[2]
சாயப் பொருட்களில் நிறம் நிறுத்தியாகவும் துத்தநாக நைட்ரேட்டைப் பயன்படுத்த முடியும். உதாரணமாக துத்தநாக கார்பனேட்டு வீழ்படிவாகக் கிடைக்கும் பின்வரும் வினையைக் குறிப்பிடலாம்.
- Zn(NO3)2 + Na2CO3 → ZnCO3 + 2 NaNO3.
மேற்கோள்கள்
- Barnett, Sarah A; Champness, Neil R (November 2003). "Structural diversity of building-blocks in coordination framework synthesis—combining M(NO3)2 junctions and bipyridyl ligands". Coordination Chemistry Reviews 246 (1-2): 145–168. doi:10.1016/S0010-8545(03)00121-8.
- Greene, Lori E.; Yuhas, Benjamin D.; Law, Matt; Zitoun, David; Yang, Peidong (September 2006). "Solution-Grown Zinc Oxide Nanowires". Inorganic Chemistry 45 (19): 7535–7543. doi:10.1021/ic0601900.
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 |
C | NO− 3, NH4NO3 |
O | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)3, Fe(NO3)2 |
Co(NO3)2, Co(NO3)3 |
Ni(NO3)2 | Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | Br | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru | Rh | Pd(NO3)2 | AgNO3 | Cd(NO3)2 | In | Sn | Sb(NO3)3 | Te | I | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2(NO3)2, Hg(NO3)2 |
Tl(NO3)3, TlNO3 |
Pb(NO3)2 | Bi(NO3)3 BiO(NO3) |
Po | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3, Ce(NO3)4 |
Pr | Nd(NO3)3 | Pm | Sm | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy | Ho | Er | Tm | Yb | Lu | |||
| Ac(NO3)3 | Th(NO3)4 | Pa | UO2(NO3)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||