பலேடியம்(II) நைட்ரேட்டு
பலேடியம்(II) நைட்ரேட்டு (Palladium(II) nitrate) என்பது Pd(NO3)2 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். நீர் ஈர்க்கும் தன்மை கொண்ட இச்சேர்மம் செம்பழுப்பு நிறத்தில் திண்மமாகக் காணப்படுகிறது. நைட்ரிக் அமிலத்தில் ஒரு கரைசலாக, ஆல்க்கீன்களை இருநைட்ரேட்டு எசுத்தர்களாக மாற்றும் வினையில் இச்சேர்மம் வினையூக்கியாகப் பயன்படுகிறது. காற்றில்லா வெப்பமூட்டலின் போது இச்சேர்மம் பலேடியம் ஆக்சைடை[1] உருவாக்குகிறது.
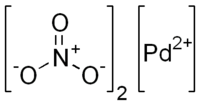 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
பலேடியம்(II) நைட்ரேட்டு | |
| வேறு பெயர்கள்
பலேடியம் நைட்ரேட்டு பலேடசு நைட்ரேட்டு | |
| இனங்காட்டிகள் | |
| 10102-05-3 | |
| ChemSpider | 23306 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24932 |
SMILES
| |
| பண்புகள் | |
| Pd(NO3)2 | |
| வாய்ப்பாட்டு எடை | 230.43 கி/மோல் |
| தோற்றம் | செம்பழுப்பு நிரத் திண்மம் |
| உருகுநிலை | |
| கரையும் | |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | எரிச்சலூட்டும், புண் ஏற்படவும் வாய்ப்புண்டு |
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றாது |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | பலேடியம்(II) குளோரைடு |
| ஏனைய நேர் மின்அயனிகள் | நிக்கல்(II) நைட்ரேட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
பலேடியம் ஆக்சைடு நீரேற்றை நீர்த்த நைட்ரிக் அமிலத்தில் கரைத்து தொடர்ந்து அக்கரைசலைப் படிகமாக்குவதன் மூலம் பலேடியம் நைட்ரேட்டைத் தயாரிக்கலாம். மஞ்சள் கலந்த பழுப்பு நிறத்தில் நீர் ஈர்க்கும் பட்டகங்களாக இந்நைட்ரேட்டு படிகமாகிறது. பலேடியம் உலோகத்தை நைட்ரிக் அமிலத்துடன் வினைபுரியச் செய்தும் பலேடியம் நைட்ரேட்டைத் தயாரிக்கலாம்.
மேற்கோள்கள்
- Timothy T. Wenzel "Palladium(II) Nitrate" Encyclopedia of Reagents for Organic Synthesis 2001, John Wiley & Sons. எஆசு:10.1002/047084289X.rp013 10.1002/047084289X.rp013
நைத்திரேட்டு அயனியின் உப்புகள், சக பிணைப்பு கிளைப் பொருள்கள்
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 |
C | NO− 3, NH4NO3 |
O | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)3, Fe(NO3)2 |
Co(NO3)2, Co(NO3)3 |
Ni(NO3)2 | Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | Br | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru | Rh | Pd(NO3)2 | AgNO3 | Cd(NO3)2 | In | Sn | Sb(NO3)3 | Te | I | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2(NO3)2, Hg(NO3)2 |
Tl(NO3)3, TlNO3 |
Pb(NO3)2 | Bi(NO3)3 BiO(NO3) |
Po | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3, Ce(NO3)4 |
Pr | Nd(NO3)3 | Pm | Sm | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy | Ho | Er | Tm | Yb | Lu | |||
| Ac(NO3)3 | Th(NO3)4 | Pa | UO2(NO3)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
This article is issued from
Wikipedia.
The text is licensed under Creative
Commons - Attribution - Sharealike.
Additional terms may apply for the media files.