பெரிலியம் புரோமைடு
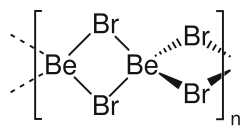
பெரிலியம் புரோமைடு ( Beryllium bromide ) என்பது BeBr2 என்ற மூலக்கூறு வாய்பாடு கொண்ட ஒரு வேதிச் சேர்மமாகும். இது நீரை நன்றாக உறிஞ்சும் மற்றும் நீரில் நன்றாக கரையும். இச்சேர்மம் நான்முக பெரிலியம் மையங்களைக் கொண்ட ஒரு பல்லுறுப்பியாகும்[1]
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
பெரிலியம் புரோமைடு | |
| இனங்காட்டிகள் | |
| 7787-46-4 | |
| ChemSpider | 74208 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 82230 |
SMILES
| |
| பண்புகள் | |
| BeBr2 | |
| வாய்ப்பாட்டு எடை | 168.820 g/mol |
| தோற்றம் | colorless white crystals |
| அடர்த்தி | 3.465 g/cm3 (20 °C) |
| உருகுநிலை | |
| கொதிநிலை | 520 °C (968 °F; 793 K) |
| Highly | |
| கரைதிறன் | எத்தனால், இருஈத்தைல் ஈதர், பிரிடின் இவற்றில் கரையும். பென்சீனில் கரையாது. |
| கட்டமைப்பு | |
| படிக அமைப்பு | Orthorhombic |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-2.094 kJ/g |
| நியம மோலார் எந்திரோப்பி S |
9.5395 J/K |
| வெப்பக் கொண்மை, C | 0.4111 J/g K |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | see Berylliosis |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | பெரிலியம் புளோரைடு பெரிலியம் குளோரைடு பெரிலியம் அயோடைடு |
| ஏனைய நேர் மின்அயனிகள் | மக்னீசியம் புரோமைடு கால்சியம் புரோமைடு இசுட்ரோன்சியம் புரோமைடு பேரியம் புரோமைடு ரெடியம் புரோமைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
தயாரிப்பும் வேதிவினைகளும்
பெரிலியம் உலோகம் தனிம புரோமினுடன் 500 பாகை செல்சியசு முதல் 700 பாகை செல்சியசு வெப்பநிலையில் வினைபுரிவதால் பெரிலியம் புரோமைடு கிடைக்கிறது.
- Be + Br2 → BeBr2
பெரிலியம் ஆக்சைடை ஐதரோ புரோமிக் அமிலத்துடன் சேர்த்து வினைபுரிய வைப்பதாலும் பெரிலியம் புரோமைடு தயாரிக்கலாம்.
- BeO + 2 HBr → BeBr2 + H2O
பெரிலியம் புரோமைடு நீருடன் சேர்ந்து மெதுவாக நீராற்பகுப்பு அடைகிறது.
- BeBr2 + 2 H2O → 2 HBr + Be(OH)2
பாதுகாப்பு
பெரிலியம் சேர்மங்கள் நச்சுதன்மை கொண்டவை எனவே அவற்றை சுவாசிப்பதும் அல்லது உட்கொள்ளுவதும் தீங்கை விளைவிக்கும்
மேற்கோள்கள்
- Crystal modifications of Beryllium dihalides BeCl2, BeBr2, and BeI2 Troyanov, S. I. Zhurnal Neorganicheskoi Khimii (2000), 45(10), 1619-1624.
This article is issued from
Wikipedia.
The text is licensed under Creative
Commons - Attribution - Sharealike.
Additional terms may apply for the media files.