மக்னீசியம் அயோடைடு
மக்னீசியம் அயோடைடு (Magnesium iodide) என்பது MgI2 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு வேதிச் சேர்மம் ஆகும். இச்சேர்மத்தின் பல்வேறு நீரேற்றுகள் MgI2(H2O)x என்ற பொதுவாய்ப்பாட்டால் குறிக்கப்படுகின்றன. இவ்வகை அயனி ஆலைடு உப்புகள் யாவும் நீரில் நன்றாகக் கரையக்கூடியனவாக உள்ளன.
| |||
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
மக்னீசியம் அயோடைடு | |||
| இனங்காட்டிகள் | |||
| 10377-58-9 (நீரிலி) 75535-11-4 (அறுநீரேற்று) 7790-31-0 (எண்ணீரேற்று) | |||
| ChemSpider | 59700 | ||
| EC number | 233-825-1 | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 66322 | ||
SMILES
| |||
| பண்புகள் | |||
| MgI2 (நீறிலி) MgI2.6H2O (அறுநீரேற்று) MgI2.8H2O (எந்நீரேற்று)[1] | |||
| வாய்ப்பாட்டு எடை | 278.1139 கி/மோல் (நீரிலி) 386.2005 கி/மோல் (அறுநீரேற்று) 422.236 கி/மோல் (எந்நீரேற்று) | ||
| தோற்றம் | வெண்மைநிறப் படிகத்திண்மம் | ||
| மணம் | நெடியற்றது | ||
| அடர்த்தி | 4.43 கி/செ.மீ3 (நீரிலி திண்மம்) 2.353 கி/செ.மீ3 (அறுநீரேற்று திண்மம்) 2.098 கி/செ.மீ3 (எந்நீரேற்று திண்மம்) | ||
| உருகுநிலை | |||
| 54.7 கி/100 செ.மீ3 (நீரிலி, 0 °செ) 148 கி/100 செ.மீ3 (நீரிலி, 18 °செ)[2] 81 கி/100 செ.மீ3 (எந்நீரேற்று, 20 °செ) | |||
| கரைதிறன் | ஈதர், ஆல்ககால் மற்றும் அமோனியா ஆகியனவற்றில் கரையும் | ||
| கட்டமைப்பு | |||
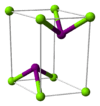
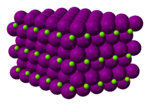
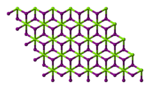
| படிக அமைப்பு | அறுகோணம் (நீரிலி) ஒற்றைச்சரிவு (அறுநீரேற்று) சாய்சதுரம் (எந்நீரேற்று) | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
-364 கியூ/மோல் | ||
| நியம மோலார் எந்திரோப்பி S |
134 யூ/மோல் K | ||
| வெப்பக் கொண்மை, C | 74 யூ/மோல் K | ||
| தீங்குகள் | |||
| R-சொற்றொடர்கள் | R36 R38 R42 R43 R61 | ||
| S-சொற்றொடர்கள் | S22 S36/37/39 S45 S53[3] | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | மக்னீசியம் புளோரைடு மக்னீசியம் புரோமைடு மக்னீசியம் குளோரைடு | ||
| ஏனைய நேர் மின்அயனிகள் | பெரிலியம் அயோடைடு கால்சியம் அயோடைடு இசுட்ரோன்சியம் அயோடைடு பேரியம் அயோடைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
பயன்கள்
சில வனிக உபயோகங்களுக்கு மக்னீசியம் அயோடைடு பயன்பட்டாலும் பிரதானமாக இதை கரிமத் தொகுப்பு வினைகளில் பயன்படுத்த இயலும்.
தயாரிப்பு
மக்னீசியம் ஆக்சைடு, மக்னீசியம் ஐதராக்சைடு மற்றும் மக்னீசியம் கார்பனேட்டு ஆகியவற்றை ஐதரோ அயோடிக் அமிலத்துடன் வினைபுரியச் செய்து மக்னீசியம் அயோடைடைத் தயாரிக்கலாம்.[4]
வினைகள்
ஐதரசன் சூழலில் உயர் வெப்ப நிலையில் மக்னீசியம் அயோடைடு நிலைப்புத் தன்மையுடன் உள்ளது, ஆனால் சாதாரண வெப்பநிலையில் காற்றில் சிதைவடைந்து தனிமநிலை அயோடினை வெளியேற்றி பழுப்பு நிறமாக மாறுகிறது. காற்றில் சூடாக்கும் போது மக்னீசியம் அயோடைடு முழுவதுமாகச் சிதைவடைந்து மக்னீசியம் ஆக்சைடாக[5] மாறுகிறது.
தூளாக்கப்பட்ட தனிமநிலை அயோடினுடன் மக்னீசியம் உலோகத்தைச் சேர்த்து வினைப்படுத்துவதாலும் மக்னீசியம் அயோடைடை தயாரிக்க முடியும். நீரற்ற மக்னீசியம் அயோடைடைத் தயாரிக்க வேண்டுமெனில் வினையானது உலர் சூழ்நிலையில் நடைபெற வேண்டும். மற்றும் உலர் இருயெத்தில் ஈதர் கரைப்பானாகப் பயன்படுத்தப்பட்டிருக்க வேண்டும்.
பெய்லிசு இல்மான் வினையில் வைனைல் சேர்மங்களைத் தயாரிக்க மக்னீசியம் அயோடைடு பயன்படுகிறது.[6]
மேற்கோள்கள்
- Perry, Dale L.; Phillips, Sidney L. (1995), Handbook of Inorganic Compounds, CRC Press, p. 240, ISBN 0-8493-8671-3, retrieved 2007-12-09
- Magnesium Iodide MSDS at AlfaAesar
- Safety (MSDS) data for magnesium iodide
- Patnaik, Pradyot (2003), Handbook of Inorganic Chemicals, McGraw-Hill Professional, pp. 527–528, ISBN 0-07-049439-8, retrieved 2007-12-09
- Wilsmore, N. T. M.(1891).James Hector "Note on Magnesium Iodide". Report of the Third Meeting of the Australasian Association for the Advancement of Science, 116, Sydney:The Association. 2007-12-09 அன்று அணுகப்பட்டது..
- Tietze, Lutz-Friedjan; Brasche, Gordon; Gericke, Kersten (2006), Domino Reactions in Organic Synthesis, Wiley-VCH, p. 59, ISBN 3-527-29060-5, retrieved 2007-12-09