மங்கனீசீரொக்சைடு
மங்கனீசு(IV) ஒக்சைடு (Manganese(IV) oxide) அல்லது மங்கனீசு ஈரொக்சைடு (Manganese dioxide) என்பது MnO
2 என்ற மூலக்கூறு வாய்ப்பாடுடைய நாலாம் ஒக்சியேற்ற நிலையிலிருக்கும் மங்கனீசின் சேர்மம் ஆகும். இது கடும் கபில அல்லது கறுப்பு நிறத்தில் காணப்படும். இது பிரதானமாக உலர் மின்கலங்களில் பிரதான கூறுகளில் ஒன்றாகப் பயன்படுகின்றது. இயற்கையாக MnO
2 பைரோலூசைட் என்ற கனிய வடிவில் கிடைக்கின்றது. இதுவே மங்கனீசின் பலவிதச் சேர்மங்களை ஆக்குவதன் தொடக்கப் பொருளாகும். உதாரணமாக மங்கனீசீரொக்சைடை பொட்டாசியம் மங்கனேற்றாக (K2MnO4) மாற்றி பின்னர் பொட்டாசியம் பரமங்கனேற்று (KMnO4) உருவாக்கப்படுகின்றது.
_oxide.jpg) | |
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்s
Manganese oxide Manganese(IV) oxide | |
| வேறு பெயர்கள்
Pyrolusite | |
| இனங்காட்டிகள் | |
| 1313-13-9 | |
| ChemSpider | 14117 |
| EC number | 215-202-6 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 14801 |
| வே.ந.வி.ப எண் | OP0350000 |
SMILES
| |
| பண்புகள் | |
| MnO2 | |
| வாய்ப்பாட்டு எடை | 86.9368 g/mol |
| தோற்றம் | கருமையான திண்மம் |
| அடர்த்தி | 5.026 g/cm3 |
| உருகுநிலை | |
| நீரில் கரையாது | |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
−520 kJ·mol−1 |
| நியம மோலார் எந்திரோப்பி S |
53 J·mol−1·K−1 |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 0175 |
| ஈயூ வகைப்பாடு | ஆபத்தான (Xn) ஒக்சியேற்றும் பொருள் (O) |
| R-சொற்றொடர்கள் | R20/22 |
| S-சொற்றொடர்கள் | (S2), S25 |
| தீப்பற்றும் வெப்பநிலை | 535 °C (995 °F; 808 K) |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | மங்கனீசு இருசல்பைடு |
| ஏனைய நேர் மின்அயனிகள் | டெக்னேடியம் ஈரொக்சைட் ரீனியம் ஈரொக்சைட் |
| மங்கனீசின் ஒக்சைட்டுகள் தொடர்புடையவை |
மங்கனீசு(II) ஒக்சைட் மங்கனீசு(II,III) ஒக்சைட் மங்கனீசு(III) ஒக்சைட் மங்கனீசு ஹெப்டொக்சைட் |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
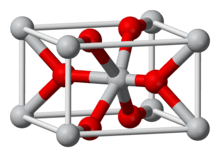
வேதியியல் கட்டமைப்பு
மங்கனீசீரொக்சைட் ஒரு ஒக்சிசன் குறைவான அசேதனச் சேர்வையாகும். மங்கனீசின் இன்னொரு ஒக்சைடான மங்கனீசு ஹெப்டொக்சைட்டே அதிகளவான ஒக்சிசனுள்ள வடிவமாகும். மங்கனீசீரொக்சைட்டில் மங்கனீசு +4 ஒக்சியேற்றும் நிலையில் காணப்படும். இதற்கு வேற்று வடிவமைப்புகளாக β-MnO2 போன்ற வடிவங்கள் முன்மொழியப்பட்டுள்ளன.
உற்பத்தி
இயற்கையாகக் கிடைக்கும் மங்கனீசீரொக்சைட் தூயதாகக் கிடைக்காது. இதில் +3 ஒக்சியேற்றும் நிலையிலும் மங்கனீசு காணப்படலாம். தூய்மையற்ற மங்கனீசீரொக்சைட்டை உலர் மின்கல உற்பத்தி போன்ற தொழிற்சாலை உற்பத்திகளுக்குப் பயன்படுத்த இயலாது. எனவே இத்தூய்மையற்ற வடிவம் தூய்மையாக்கப்படுகின்றது அல்லது வேறு வழிமுறைகளால் தூய செயற்கையான மங்கனீசீரொக்சைடு உற்பத்தி செய்யப்படுகின்றது. தூய்மையாக்கும் முறை இரசாயன மங்கனீசீரொக்சைட் (Chemical manganese dioxide-CMD) எனவும், தூய மங்கனீசை செயற்கையாக உற்பத்தி செய்யும் முறை மின்பகுப்பு மங்கனீசீரொக்சைட் (Electrolytical manganese dioxide-EMD) எனவும் அழைக்கப்படுகின்றன.
இரசாயன மங்கனீசீரொக்சைட்
இது சாதாரணப் பயன்பாடுகளுக்குப் பொருத்தமான மங்கனீசீரொக்சைட்டை உற்பத்தி செய்யும் முறையாகும். இதன் போது N2O4 மற்றும் நீரைப் பயன்படுத்தி மங்கனீசீரொக்சைட்டு தூய்மையாக்கப்படுகின்றது. இம்மூன்றும் தாக்கமடைந்து மங்கனீசு(II) நைத்திரேற்றைத் தோற்றுவிக்கின்றன. இவ்வுப்பு நீரில் கரைந்து காணப்படும். இக்க்ரைசலிலுள்ள நீரை அகற்றி உப்பு வேறாகப் பெறப்படும். மங்கனீசு(II)நைத்திரேற்றை 400 °C வெப்பநிலைக்குச் சூடாக்கினால் அது வெப்பப்பிரிகையடைந்து மீண்டும் N2O4யும் ஓரளவுக்குத் தூய மங்கனீசீரொக்சட்டையும் கொடுக்கும்.
- MnO2 + N2O4 Mn(NO3)2
இன்னொரு முறையில் மங்கனீசீரொக்சைட்டுத் தாதானது கரி அல்லது மசகெண்ணையுடன் சூடாக்கப்பட்டு MnO ஆகத் தாழ்த்தப்படும். தாழ்த்தப்பட்ட MnO மற்றும் பிற மாசுக்களின் கலவை சல்பூரிக் அமிலத்துக்குள் இடப்பட்டு பின்னர் வடிகட்டப்படும். பின்னர் அமோனியம் காபனேற்றுடன் (NH4CO3) தாக்கமடையச் செய்து மங்கனீசுக் காபனேற்று (MnCO3) பெறப்படும். மங்கனீசு காபனேற்றை வளியில் நீற்றுதலுக்குட்படுத்தி (வளியில் காபனீரொக்சைட்டு வெளியேறும் மட்டும் வெப்பமேற்றல்). இதன் போது MnO மற்றும் MnO2 ஆகிய இரு விளைவுகளும் கிடைக்கும். இதனை மீண்டும் சல்பூரிக் அமிலத்தில் கரைத்து சோடியம் குளோரேற்று (NaClO3) போன்ற ஒக்சியேற்றும் பொருட்களால் ஒக்சியேற்றி அனைத்து MnO மற்றும் Mn2O3 ஆகியன MnO2 ஆக மாற்றப்படுகின்றன. இதன் போது குளோரீன் வாயு பக்கவிளைபொருளாக வெளியேற்றப்படும். விளைபொருள் வடிகட்டப்பட்டு தூய மங்கனீசீரொக்சைட் பெறப்படுகின்றது.
மின்பகுப்பு மங்கனீசீரொக்சைட்
இம்முறையில் பெறப்படும் அதி தூய்மையான மங்கனீசீரொக்சைட்டே உலர் கலங்களின் உற்பத்திக்குப் பயன்படுத்தப்படுகின்றது.
வேதியற் தாக்கங்கள்
மங்கனீசீரொக்சைட்டு தாழ்த்தல் மற்றும் ஒக்சியேற்றலில் ஈடுபடக்கூடிய ஒரு அயன் சேர்வையாகும்.
தாழ்த்தல் தாக்கங்கள்
மங்கனீசீரொக்சைட்டைக் கார்பனைப் பயன்படுத்தித் தாழ்த்துவதன் மூலம் மங்கனீசு உலோகம் பிரித்தெடுக்கப்படுகின்றது.
- MnO
2 + 2 C → Mn + 2 CO
உலர் மின்கலங்களில் மங்கனீசீரொக்சைட்டின் தாழ்த்தல் முக்கியமான தாக்கமாகும்.:
- MnO
2 + e− + H+ → MnO(OH)
MnO
2 பல தாக்கங்களில் ஊக்கியாகச் செயற்பட்டு O
2 வாயுவை வெளியிடச்செய்கின்றது. உதாரணமாக பொட்டாசியம் குளோரேற்றை (KClO3) பொட்டாசியம் குளோரைட்டாகத் (KCl) தாழ்த்துகின்றது.
2KClO3 → 2KCl + 3O
2
ஐதரசன் பரவொக்சைட்டை நீராகவும் ஒக்சிசனாகவும் பிரிகையடைய MnO
2 ஊக்கியாகத் தொழிற்பட்டு உதவுகின்றது:
- 2 H2O2 → 2 H2O + O2
530 °C வெப்பநிலையில் மங்கனீசீரொக்சைட்டு மங்கனீசு(III)ஒக்சைட்டாகவும் ஒக்சிசனாகவும் பிரிகையடையும். 1000 °C வெப்பநிலையில் Mn3O4 ஆகப் பிரிகையடையும். மேலும் அதிகமான வெப்பநிலையில் MnO ஆகப் பிரிகையடையும்.
செறிந்த வெப்பமாக்கப்பட்ட சல்பூரிக் அமிலம் MnO2வை மங்கனீசு(II)சல்பேற்றாகத் தாழ்த்தும்:
- 2 MnO2 + 2 H2SO4 → 2 MnSO4 + O2 + 2 H2O
ஒக்சியேற்றும் தாக்கங்கள்
பொட்டாசியம் ஐதரொக்சைட்டையும் ஒக்சிசனையும் பயன்படுத்தி மங்கனீசீரொக்சைட்டை ஒக்சியேற்றி பச்சை நிறமான பொட்டாசியம் மங்கனேற்றை உருவாக்கலாம். இதனைப் பயன்படுத்திப் பின்னர் பொட்டாசியம் பரமங்கனேற்றை உருவாக்கலாம்.
- 2 MnO2 + 4 KOH + O2 → 2 K2MnO4 + 2 H2O
பயன்பாடு
- உலர் மின்கலங்களில் இது பயன்படுத்தப்படுகின்றது. ஒவ்வொரு வருடமும் இதற்காக 500000 தொன் மங்கனீசீரொக்சைடு உற்பத்தி செய்யப்படுகின்றது. முக்கியமாக நாக-கார்பன் மின்கலத்தில் கார்பன் கோலைச் சூழ இது இடப்பட்டிருக்கும்.
- நிறப்பூச்சாகப் பயன்படுத்தப்படுகின்றது.