জার্মেনিয়াম
জার্মেনিয়াম হলো ৩২ পারমাণবিক সংখ্যা বিশিষ্ট একটি মৌল যার প্রতীক Ge। এটি কার্বন শ্রেণীর একটি উজ্জ্বল, শক্ত-ভঙ্গুর, ধূসরাভ-সাদা ধাতুকল্প রাসায়নিক উপাদান। রাসায়নিকভাবে একই গ্রুপের সিলিকন ও টিনের সাথে সাদৃশ্যপূর্ণ। সিলিকনের মতোই জার্মেনিয়াম অর্ধপরিবাহিতা প্রদর্শন করে। সিলিকনের মতোই জার্মেনিয়াম প্রকৃতিতে অক্সিজেনের সাথে বিক্রিয়া করে যৌগ উৎপন্ন করে।
 A 12 gram (2x3 cm) polycrystalline block of Ge with uneven cleaved surfaces | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পরিচয় | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| নাম, প্রতীক | জার্মেনিয়াম, Ge | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| উচ্চারণ | /dʒərˈmeɪniəm/ jər-MAY-nee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| উপস্থিতি | ধুসর-সাদা | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পর্যায় সারণীতে জার্মেনিয়াম | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক সংখ্যা | 32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| আদর্শ পারমাণবিক ভর | 72.63(1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| মৌলের শ্রেণী | metalloid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| শ্রেণী, পর্যায়, ব্লক | ১৪, পর্যায় ৪, p-ব্লক | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ইলেকট্রন বিন্যাস | [Ar] 3d10 4s2 4p2 per shell: 2, 8, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ভৌত বৈশিষ্ট্য | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| দশা | কঠিন | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| গলনাঙ্ক | 1211.40 কে (938.25 °সে, 1720.85 °ফা) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| স্ফুটনাঙ্ক | 3106 K (2833 °সে, 5131 °ফা) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ঘনত্ব (ক.তা.-র কাছে) | 5.323 g·cm−৩ (০ °সে-এ, ১০১.৩২৫ kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তরলের ঘনত্ব | m.p.: 5.60 g·cm−৩ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ফিউশনের এনথালপি | 36.94 kJ·mol−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| বাষ্পীভবনের এনথালপি | 334 kJ·mol−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপ ধারকত্ব | 23.222 J·mol−১·K−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
বাষ্প চাপ
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক বৈশিষ্ট্য | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| জারণ অবস্থা | 4, 3, 2, 1, 0, -1, -2, -3, -4 (amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তড়িৎ-চুম্বকত্ব | 2.01 (পলিং স্কেল) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক ব্যাসার্ধ | empirical: 122 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| সমযোজী ব্যাসার্ধ | 122 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ভ্যান ডার ওয়ালস ব্যাসার্ধ | 211 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| বিবিধ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| কেলাসের গঠন | diamond cubic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| শব্দের দ্রুতি | পাতলা রডে: 5400 m·s−১ (at 20 °সে) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপীয় প্রসারাঙ্ক | 6.0 µm·m−১·K−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপীয় পরিবাহিতা | 60.2 W·m−১·K−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তড়িৎ রোধকত্ব ও পরিবাহিতা | ২০ °সে-এ: 1 Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| চুম্বকত্ব | Diamagnetic[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ইয়ংয়ের গুণাঙ্ক | 103[2] GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| কৃন্তন গুণাঙ্ক | 41[2] GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| আয়তন গুণাঙ্ক | 75[2] GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পোয়াসোঁর অনুপাত | 0.26[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (মোজ) কাঠিন্য | 6.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ক্যাস নিবন্ধন সংখ্যা | 7440-56-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| সবচেয়ে স্থিতিশীল আইসোটোপ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
প্রকৃতিতে একসাথে উল্লেখযোগ্য পরিমাণে পাওয়া না যাওয়ায় রসায়নের ইতিহাসে জার্মেনিয়াম অপেক্ষাকৃত অনেক পরে আবিষ্কৃত হয়। পৃথিবীপৃষ্ঠে প্রাপ্য সহজলভ্য মৌলের মধ্যে জার্মেনিয়ামের অবস্থান ৫০তম। ১৮৬৯ সালে দিমিত্রি ম্যান্ডেলিভ তার পর্যায় সারণীতে অবস্থান থেকে জার্মেনিয়ামের কিছু রাসায়নিক বৈশিষ্ট্য ব্যাখ্যা করেন ও মৌলের অস্তিত্ব সম্পর্কে ভবিষ্যদ্বানী করেন। তিনি মৌলটিকে একাসিলিকন নামে অভিহিত করেন। প্রায় দুই দশক পরে ১৮৮৬ সালে ক্লিমেন্স উইঙ্কলার আর্গাইরোডাইট নামের একটি দুর্লভ খনিজে রূপা ও গন্ধকের সাথে একটি নতুন মৌল আবিষ্কার করেন। আপাতদৃষ্টিতে নতুন আবিষ্কৃত মৌলটি আর্সেনিক ও অ্যান্টিমনির সাথে সাদৃশ্যপূর্ণ মনে হলেও, রাসায়নিক যৌগের সংযুক্তি বিশ্লেষণ করে মৌলটিকে ম্যান্ডেলিভের ভবিষ্যদ্বাণীমতো সিলিকনের সাথে সম্পর্কিত বলে মত দেন। উইঙ্কলার তার দেশ জার্মানির নামানুসারে যৌগের নাম রাখেন জার্মেনিয়াম। বর্তমানে, দস্তার প্রাথমিক আকরিক স্ফালেরাইট থেকে জার্মেনিয়াম নিষ্কাশিত হয়, তবে বাণিজ্যিকভাবে রূপা, সীসা ও তামার আকরিক থেকেও জার্মেনিয়াম পুনরুদ্ধার করা হয়।
জার্মেনিয়াম মৌল অর্ধপরিবাহী হিসেবে ট্রানজিস্টরে ও অন্যান্য ইলেকট্রনিক যন্ত্রে ব্যবহার করা হয়। ঐতিহাসিকভাবে অর্ধপরিবাহী ইলেকট্রনিক্সের প্রথম দশক সম্পূর্ণরূপে জার্মেনিয়ামের ওপর নির্ভরশীল ছিল। বর্তমানে জার্মেনিয়ামের প্রধান ব্যবহার অপটিক্যাল ফাইবার ব্যবস্থা, অবলোহিত ফাইবার, সৌর কোষ ও এলইডিতে। পলিমারকরণ বিক্রিয়ার প্রভাবক হিসেবে এবং সাম্প্রতিককালে ন্যনোওয়্যার উৎপাদনে জারমেনিয়াম যৌগ ব্যবহৃত হয়। এই মৌলটি টেট্রাইথাইলজার্মেনিয়ামের মতো বেশ কয়েকটি জৈব-জার্মেনিয়াম যৌগ গঠন করে, যা জৈব-ধাতব রসায়নে তাৎপর্যপূর্ণ। জার্মেনিয়ামকে প্রযুক্তির জন্য তাৎপর্যপূর্ণ মৌল হিসেবে বিবেচনা করা হয়।
জীব দেহের জন্য জার্মেনিয়ামকে অত্যাবশ্যকীয় উপাদান হিসেবে গণ্য করা হয় না। জার্মেনিয়ামের কিছু জটিল জৈব যৌগ ঔষধ শিল্পের জন্য পরীক্ষা করা হচ্ছে, যদিও এ পর্যন্ত সাফল্য পাওয়া যায় নি। সিলিকন ও অ্যালুমিনিয়ামের মতো প্রাকৃতিক জার্মেনিয়াম যৌগসমূহ পানিতে সাধারণত অদ্রবণীয় এবং এ কারণে মুখে প্রবেশে সামান্য বিষাক্ততা প্রদর্শন করে। তবে কৃত্রিমভাবে সংশ্লেষিত দ্রবণীয় জারমেনিয়াম লবণসমূহ বৃক্কে বিষাক্ততা প্রদর্শন করে। হ্যালোজেন ও হাইড্রোজেনযুক্ত কৃত্রিম সংশ্লেষিত রাসায়নিক সক্রিয় জার্মেনিয়াম যৌগসমূহ বিষাক্ত।
ইতিহাস
.svg.png)
১৮৬৯ সালে রাশিয়ান রসায়নবিদ দিমিত্রি ম্যান্ডেলিভ তার মৌলের পর্যায়বৃত্তিক সূত্র-এ বেশ কয়েকটি মৌলিক পদার্থের অস্তিত্ব সম্পর্কে ভবিষ্যৎবাণী করেন। এর মধ্যে কার্বন শ্রেণীতে সিলিকন ও টিনের মধ্যে একটি মৌল অন্যতম।[3] পর্যায় সারণীতে অবস্থানের জন্য ম্যান্ডেলিভ এর নাম দেন একাসিলিকন (Es), এবং আণবিক ভর ৭০ (পরবর্তীতে ৭২) বলে ধারণা করেন।
১৮৮৫ সালের মাঝামাঝিতে জার্মানির স্যাক্সনি রাজ্যের ফ্রিবার্গ শহরের কাছাকাছি রূপাসমৃদ্ধ একটি নতুন খনিজ আবিষ্কৃত হয় এবং এর নামকরণ করা হয় আর্গাইরোডাইট। গ্রিক আর্গাইরোডাইট শব্দের অর্থ রূপা-ধারণকারী।[4] রসায়নবিদ ক্লিমেন্স উইঙ্কলার নতুন খনিজটিকে বিশ্লেষণ করে রূপা, গন্ধক ও একটি নতুন মৌলের সন্ধান পান। উইঙ্কলার ১৮৮৬ সালে নতুন মৌলটিকে আলাদা করতে সক্ষম হন এবং অ্যান্টিমনির সাথে সাদৃশ্য খুঁজে পান। তিনি প্রাথমিকভাবে মৌলটিকে একা-অ্যান্টিমনি হিসেবে শনাক্ত করলেও পরবর্তীতে মৌলটি একা-সিলিকন বলে চিহ্নিত করেন।[5][6] উইঙ্কলারের নতুন মৌলের প্রতিবেদনটি প্রকাশের পূর্বে মৌলটির নাম ন্যাপচুনিয়াম রাখার সিদ্ধান্ত নেন, কেননা ১৮৪৬ সালে মৌলটির মতো পূর্ব ভবিষ্যদ্বাণী অনুযায়ী নেপচুন গ্রহ আবিষ্কৃত হয়। (১৮৪৩ সালে দুই গণিতবিদ জন কাউচ অ্যাডামস ও আরবেইন লি ভ্যারিয়ার সেলেস্টিয়াল মেকানিক্স পদ্ধতিতে হিসাব নিকাশ করে নেপচুন গ্রহের অস্তিত্বের কথা প্রকাশ করেন। মহাকাশ পর্যবেক্ষণে দেখা যায় ইউরেনাস গ্রহ তার কক্ষপথ থেকে সামান্য বিচ্যুত থাকে, এর কারণ ব্যাখ্যা করতে গিয়ে নেপচুনের অস্তিত্বের ধারণ দেন।[7] জেমস ক্যালিস ১৮৪৬ সালের জুলাইয়ে অনুসন্ধান শুরু করেন এবং ১৮৪৬ সালের ২৩ সেপ্টেম্বর গ্রহটি পর্যবেক্ষণ করেন।[8]) কিন্তু আগেই অন্য একটি মৌলের নাম হিসেবে ন্যাপচুন প্রস্তাবিত হয়ে যায়। যদিও মৌলটি বর্তমানের ন্যাপচুনিয়াম মৌল (১৯৪০ সালে আবিষ্কৃত) নয়। ১৮৭৭ সালে আর হারম্যান পর্যায় সারণীতে ট্যানটালামের নিচে অবস্থিত তার আবিষ্কৃত নতুন মৌলের নাম গ্রিক সমুদ্র দেবতার নামানুসারে ন্যাপচুনিয়াম প্রস্তাব করেন।[9][10] অবশ্য পরবর্তীতে ধাতুটিকে নাইওবিয়াম ও ট্যানটালামের সংকর হিসেবে শনাক্ত করা হয়।[11] পরবর্তীতে পর্যায় সারণীর ইউরেনিয়ামের ঠিক পরের কৃত্রিমভাবে সংশ্লেষিত মৌলের নামকরণ করা হয় "ন্যাপচুনিয়াম", যা নিউক্লীয় পদার্থবিদরা ১৯৪০ সালে আবিষ্কার করেন।[12] তাই উইঙ্কলার তার মাতৃভূমির নামানুসারে মৌলটির নাম রাখেন জার্মেনিয়াম (জার্মানির ল্যাটিন শব্দ জার্মানিয়া থেকে)।[6] আর্গাইরোডাইট প্রকৃতপক্ষে Ag8GeS6 বলে প্রমাণিত। আর্সেনিক ও অ্যান্টিমনির সাথে সাদৃশ্যগত কারণে পর্যায় সারণীতে মৌলটির অবস্থান নিয়ে বিভ্রান্তি সৃষ্টি হয়, কিন্তু দিমিত্রি ম্যান্ডেলিভের একাসিলিকন-এর সাথে যথেষ্ট মিল থাকায় পর্যায় সারণীতে এর অবস্থান সুনির্দিষ্ট করা হয়।[6][13] ১৮৮৭ সালে স্যক্সনির খনিজ থেকে প্রায় ৫০০ কেজি আকরিক সংগ্রহ করে উইঙ্কলার নতুন মৌলটির আরও রাসায়নিক বৈশিষ্ট্য ব্যাখ্যা করেন।[5][6][14] বিশুদ্ধ জার্মেনিয়াম টেট্রাক্লোরাইড (GeCl
4) বিশ্লেষণ করে পারমাণবিক ভর ৭২.৩২ নির্ণয় করেন। আবার লিকক ডি বোইসবোড্রান মৌলের বৈদ্যুতিক বর্ণালি তুলনা করে পারমাণবিক ভর ৭২.৩ নির্ণয় করেন।[15]
উইঙ্কলার জার্মেনিয়ামের নতুন কয়েকটি মৌল, যেমন ফ্লোরাইড, ক্লোরাইড, সালফাইড, ডাইঅক্সাইড, প্রথম জৈব-জার্মেন যৌগ টেট্রাইথাইল জার্মেন (Ge(C2H5)4)[5] তৈরি করতে সক্ষম হন। এই যৌগসমূহের গাঠনিক ধর্ম ম্যান্ডেলিভের ভবিষ্যদ্বাণীর সাথে মিলে যায়, যা ম্যান্ডেলিভের পর্যায়বৃত্তিক ধর্ম সম্পর্কে অধিক নিশ্চয়তা প্রদান করে। ম্যান্ডেলিভ ও উইঙ্কলারের পর্যবেক্ষণ তথ্যের তুলনা নিম্নরূপ:[5]
| বৈশিষ্ট্য | একাসিলিকন ম্যান্ডেলিভ ভবিষ্যদ্বাণী (১৮৭১) | জার্মেনিয়াম উইঙ্কলার আবিষ্কার (১৮৮৭) |
|---|---|---|
| পারমাণবিক ভর | ৭২.৬৪ | ৭২.৫৯ |
| ঘনত্ব (গ্রাম/সেমি৩) | ৫.৫ | ৫.৩৫ |
| গলনাঙ্ক (°সে) | উচ্চ | ৯৪৭ |
| রং | ধূসর | ধূসর |
| অক্সাইডের প্রকৃতি | তাপসহ ডাইঅক্সাইড | তাপসহ ডাইঅক্সাইড |
| অক্সাইডের ঘনত্ব (গ্রাম/সেমি৩) | ৪.৭ | ৪.৭ |
| অক্সাইডের সক্রিয়তা | দুর্বল ক্ষারীয় | দুর্বল ক্ষারীয় |
| ক্লোরাইডের স্ফূটনাঙ্ক (°সে) | ১০০ এর নিচে | ৮৬ (GeCl4) |
| ক্লোরাইডের ঘনত্ব (গ্রাম/সেমি৩) | ১.৯ | ১.৯ |
১৯৩০ এর শেষ পর্যন্ত ধারণা ছিল জার্মেনিয়াম একটি খুব নিম্ন পরিবাহী ধাতু।[16] ১৯৪৫ সালের পর জার্মেনিয়ামের ইলেক্ট্রনিক অর্ধপরিবাহিতা ধর্ম আবিষ্কৃত হওয়ার আগ পর্যন্ত মৌলটির অর্থনৈতিক মূল্যবান বিবেচিত হতো না। দ্বিতীয় বিশ্বযুদ্ধের সময় বিশেষ ইলেকট্রনিক যন্ত্র বিশেষত ডায়োড তৈরিতে সামান্য পরিমাণ জার্মেনিয়াম ব্যবহৃত হয়।[17][18] যুদ্ধের সময় জার্মেনিয়ামের প্রথম গুরুত্বপূর্ণ ব্যবহার ছিল রাডারের শনাক্তকরণ যন্ত্রে পয়েন্ট-কনট্যাক্ট শটকি ডায়োডে।[16] প্রথম সিলিকন-জার্মেনিয়াম সংকর তৈরি করা হয় ১৯৫৫ সালে।[19] ১৯৪৫ এর পূর্বে খনি থেকে মাত্র কয়েকশ কিলোগ্রাম জার্মেনিয়াম আহরিত হয়। কিন্তু ১৯৫০ এর দশকের শেষ নাগাদ বৈশ্বিক উৎপাদন ৪০ metric ton (৪৪ শর্ট টন)-এ পৌঁছে যায়।[20]
১৯৪৮ সালে জার্মেনিয়াম ট্রানজিস্টরের আবিষ্কারের পর কঠিন অবস্থার ইলেকট্রনিক্সে এর ব্যবহারের মাত্রা বেড়ে যায়।[21][22] ১৯৫০ থেকে ৭০ এর দশক পর্যন্ত ইলেকট্রনিক্সে জার্মেনিয়ামের ব্যবহার অব্যাহত থাকে। কিন্তু এরপর ট্রানজিস্টর, ডায়োড ও রেকটিফায়ারে জার্মেনিয়ামের পরিবর্তে উচ্চমাত্রার বিশুদ্ধ সিলিকন ব্যবহার শুরু হয়।[23] ফেয়ারচাইল্ড সেমিকন্ডাক্টর ১৯৫৭ সালে সিলিকন ট্রানজিস্টর উৎপাদনের উদ্দেশ্যে প্রতিষ্ঠিত হয়। সিলিকনের উন্নত ইলেকট্রনীয় বৈশিষ্ট্য বিদ্যমান, কিন্তু উচ্চ মাত্রার বিশুদ্ধ অবস্থায় সিলিকন তা প্রদর্শন করে, যা কঠিন অবস্থার ইলেকট্রনিক্সের প্রাথমিক অবস্থায় অর্থনৈতিকভাবে সম্ভব ছিল না।[24]
এর মধ্যে অপটিক্যাল ফাইবার যোগাযোগ ব্যবস্থা, অবলোহিত নাইট ভিশন ব্যবস্থা ও পলিমারকরণ বিক্রিয়ার প্রভাবক হিসেবে জার্মেনিয়ামের চাহিদা নাটকীইয়ভাবে বৃদ্ধি পায়।[20] এই প্রয়োগ ২০০০ সালে জার্মেনিয়ামের মোট ব্যবহারের মাত্র ৮৫%।[23] এমনকি যুক্তরাষ্ট্র সরকার মৌলটিকে গুরুরত্বপূর্ণ হিসেবে চিহ্নিত করে এবং ১৯৮৭ সালে জাতীয় প্রতিরক্ষার জন্য ১৪৬ শর্ট টন (১৩২ মেট্রিক টন) জার্মেনিয়াম মজুদ করে।[20]
সিলিকনের সাথে জার্মেনিয়ামের মূল পার্থক্য হলো জার্মেনিয়াম উৎসের সীমাবদ্ধতা আর সিলিকনের উৎপাদন সীমাবদ্ধতা। জার্মেনিয়ামের আবিষ্কৃত খনি সীমিত, কিন্তু সিলিকন সাধারণ বালি ও কোয়ার্টজ থেকে আহরিত হয়। ১৯৯৮ সালে সিলিকনের মূল্য ছিল প্রতি কেজি $১০ এর বেশি,[20] যেখানে জার্মেনিয়ামের মূল্য ছিল প্রতি কেজি প্রায় $৮০০।[20]
বৈশিষ্ট্য
আদর্শ তাপমাত্রা ও চাপে জার্মেনিয়াম ভঙ্গুর, রজত-শুভ্র, অপধাতব মৌল।[25] জার্মেনিয়াম একটি অ্যালোট্রপ গঠন করে যা আলফা-জার্মেনিয়াম নামে পরিচিত। এর ধাতব ধাতব দ্যুতি বিদ্যমান এবং হীরকের মতোই ঘনাকাকৃতি স্ফটিকাকার কাঠামো বিদ্যমান।[23] স্ফটিক কাঠামোয় জার্মেনিয়ামের বিচ্যুতি শক্তির মান প্রায় ।[26] প্রায় ১২০ কিলোবার চাপে বিটা-জার্মেনিয়াম অ্যালোট্রোপ গঠন করে, যার কাঠামো অনেকটা বিটা-টিনের মতো।[27] সিলিকন, গ্যালিয়াম, বিসমাথ, অ্যান্টিমনি ও পানির মতো জার্মেনিয়াম তরল অবস্থা থেকে কঠিন করা হলে (বিশেষত শীতলীকরণ) আয়তনে বৃদ্ধি পায়।[27]
জার্মেনিয়াম মূলত একটি অর্ধপরিবাহী। জোন পরিশোধন প্রক্রিয়ায় জার্মেনিয়াম স্ফটিক তৈরি করা সম্ভব হয় যার ১০১০টি পরমাণুতে একটি মাত্র ভেজাল পরমাণু থাকে।[28] এইজন্য জার্মেনিয়ামকে এখন পর্যন্ত প্রাপ্ত পদার্থের মধ্যে সবচেয়ে বিশুদ্ধ হিসেবে গণ্য করা হয়।[29] ২০০৫ সালে আবিষ্কৃত একটি ধাতব পদার্থ, যা শক্তিশালী তড়িৎচুম্বকীয় ক্ষেত্রের উপস্থিতিতে অতিপরিবাহিতা প্রদর্শন করে, ছিল মূলত ইউরেনিয়াম, রোডিয়াম ও জার্মেনিয়ামের সংকর।[30]
স্ক্রু বিচ্যুতির কারণে বিশুদ্ধ জার্মেনিয়াম ধাতুমল উৎপন্ন করে। ধাতুমলটি সিস্টেমের অন্য কোনো অংশের সাথে সংযুক্ত হলে পি-এন সংযোগে বিদ্যুত প্রবাহের ভিন্ন পথ তৈরি করে। এই কারণে পুরনো জার্মেনিয়াম ডায়োড ও ট্রানজিস্টর থেকে অনেক সময় কাঙ্ক্ষিত কাজ পাওয়া যায় না।
রাসায়নিক
প্রায় ২৫০ °সে তাপমাত্রায় জার্মেনিয়াম মৌল ধীরে ধীরে জারিত হতে শুরু করে এবং GeO2 গঠন করে।[31] জার্মেনিয়াম লঘু অম্ল ও ক্ষারে অদ্রবণীয়। কিন্তু গরম ঘনীভূত সালফিউরিক ও নাইট্রিক এসিডে ধীরে ধীরে দ্রবীভূত হয় এবং গলিত ক্ষারের সাথে দ্রুত বিক্রিয়া করে জার্মানেট ([GeO
3]2−
) গঠন করে। জার্মেনিয়াম যৌগগুলো সাধারণত +৪ জারণ অবস্থায় পাওয়া গেলেও কিছু +২ যৌগের কথাই জানা যায়।[32] এছাড়া অন্যান্য দুর্লভ অবস্থা: +৩ Ge2Cl6 এবং +৩ ও +১ অবস্থা অক্সাইডের পৃষ্ঠে দেখা যায়।[33] আবার জার্মানাইড যৌগগুলোতে ঋণাত্মক জারণ অবস্থাও দেখা যায়, যেমন Mg
2Ge যৌগে -৪। ইথিলিনডাইঅ্যামাইন বা ক্রিপট্যান্ডের উপস্থিতিতে তরল অ্যামোনিয়ায় জার্মেনিয়াম ও ক্ষার ধাতুর সংকর থেকে Ge42−, Ge94−, Ge92−, [(Ge9)2]6− প্রভৃতি অ্যানায়ন (জিন্টল আয়ন) নিষ্কাশন করা হয়।[32][34] ওজোনাইডসমূহের (O3−) মতো এই যৌগসমূহে জার্মেনিয়ামের জারণ অবস্থা পূর্ণসংখ্যা হয় না।
জার্মেনিয়ামের দুইটি মাত্র অক্সাইডের কথা জানা যায়: জার্মেনিয়াম ডাইঅক্সাইড (GeO
2, জার্মেনিয়া) ও জার্মেনিয়াম মনোঅক্সাইড, (GeO)।[27] জার্মেনিয়াম ডাইসালফাইডকে (GeS
2) উত্তপ্ত করে প্রাপ্ত ডাইঅক্সাইড (GeO2) সাদা পাউডারজাতীয় পদার্থ যা পানিতে সামান্য দ্রবণীয় কিন্তু ক্ষারের সাথে দ্রুত বিক্রিয়া করে জার্মানেট উৎপন্ন করে।[27] উচ্চ তাপমাত্রায় ধাতব জার্মেনিয়ামের সাথে GeO2 এর বিক্রিয়ায় মনোঅক্সাইড (জার্মেনাস অক্সাইড) পাওয়া যায়।[27] এর ডাইঅক্সাইড (এবং সম্পর্কিত অক্সাইডসমূহ ও জার্মানেট) সাধারণ আলোর জন্য অস্বাভাবিক উচ্চ প্রতিসরণাঙ্ক প্রদর্শন করে। কিন্তু অবলোহিত আলোকে প্রায় পথ পরিবর্তন না করেই যেতে দেয়।[35][36] বিসমাথ জার্মানেট, Bi4Ge3O12, (বিজিও) অগ্নি স্ফূলিঙ্গ সৃষ্টিতে ব্যবহৃত হয়।[37]
অন্যান্য চ্যালকোজেনের সাথে জার্মেনিয়ামের কিছু দ্বিপারমাণবিক যৌগের কথা জানা যায়, যেমন, ডাইসালফাইড (GeS
2), ডাইসেলেনাইড (GeSe
2), ও মনোসালফাইড (GeS), সেলেনাইড (GeSe), এবং টেলুরাইড (GeTe) প্রভৃতি।[32] জার্মেনিয়াম (IV) যুক্ত শক্তিশালী এসিড দ্রবণে হাইড্রোজেন সালফাইড চালনা করলে GeS2 এর সাদা অধঃক্ষেপ উৎপন্ন করে।[32] পানিতে ও কস্টিক ক্ষার বা ক্ষারীয় সালফাইডের জলীয় দ্রবণে এর ডাইসালফাইড যথেষ্ট পরিমাণে দ্রবণীয়। তবে এটি অম্লীয় জলীয় দ্রবণে দ্রবীভূত হয় না। এই বৈশিষ্ট্যের জন্যই উইঙ্কলার এই মৌলটি শনাক্ত করতে সক্ষম হন।[38] হাইড্রোজেন প্রবাহে ডাইসালফাইডকে উত্তপ্ত করলে মনোসালফাইড উৎপন্ন হয়। গাঢ় বর্ণ ও ফহাতব দ্যুতির জন্য পাতলা পাতে এর আস্তর দেওয়া হয়। এটি ক্ষয়কারক ক্ষারীয় দ্রবণে দ্রবীভূত হয়।[27] ক্ষার ধাতুর কার্বোনেট ও সালফারের সাথে গলানো হলে জার্মেনিয়াম যৌগসমূহ একটি লবণ উৎপন্ন করে যা থায়োজার্মানেট নামে পরিচিত।[39]
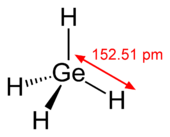
এ পর্যন্ত মৌলের চারটি টেট্রাহ্যালাইডের কথা জানা যায়। সাধারণ তাপমাত্রা ও চাপে GeI4 কঠিন, GeF4 গ্যাসীয় পদার্থ ও অন্যগুলো উদ্বায়ী তরল। ধাতব জার্মেনিয়ামকে ক্লোরিনের সাথে উত্তপ্ত করে ৮৩.১ °সে তাপমাত্রায় রংহীন ধূমায়মান তরল হিসেবে জার্মেনিয়াম টেট্রাক্লোরাইড (GeCl4) পাওয়া যায়।[27] সবগুলো টেট্রাহ্যালাইড সহজেই আর্দ্রবিশ্লেষিত হয়ে জার্মেনিয়াম ডাইঅক্সাইড উৎপন্ন করে।[27] জৈব-জার্মেনিয়াম যৌগ উৎপাদনে GeCl4 ব্যবহৃত হয়।[32] তাছাড়া চারটি ডাইহ্যালাইড সম্পর্কেই জানা যায় এবং এরা পলিমার গঠন করে বলে কঠিন অবস্থায় থাকে।[32] সেই সাথে Ge2Cl6 এবং কিছু GenCl2n+2 যৌগ সম্পর্কেও জানা যায়।[27] The unusual compound Ge6Cl16 যৌগটি (সাধারণভাবে পাওয়া যায় না) উৎপাদন করা হয়েছে যার মধ্যে Ge5Cl12 এককের নিওপেন্টেনের মতো কাঠামো বিদ্যমান।[40]
জার্মেন (GeH4) যৌগের গঠন মিথেনের অনুরূপ। পলিজার্মেন (GenH2n+2) যৌগের গঠন অনেকটা অ্যালকেনের মতো, তবে মাত্র পাঁচ জার্মেনিয়াম পরমাণুবিশিষ্ট পলিজার্মেনের সন্ধান পাওয়া যায়। [32] সিলিকনের অনুরূপ যৌগগুলোর তুলনায় জার্মেনিয়াম যৌগ কম উদ্বায়ী ও কম সক্রিয়।[32] তরল অ্যামোনিয়ায় GeH4 ক্ষার ধাতুর সাথে বিক্রিয়া করে সাদা স্ফটিকাকার MGeH3 গঠন করে যাতে GeH3− অ্যানায়ন থাকে।[32] দুই ও তিন হ্যালোজেন পরমাণুবিশিষ্ট জার্মেনিয়াম হাইড্রোহ্যালাইড বর্ণহীন সক্রিয় তরল পদার্থ।[32]
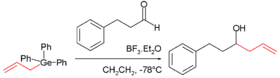
১৮৮৭ সালে উইঙ্কলার প্রথম জৈব-জার্মেনিয়াম যৌগ সংশ্লেষ করেন। তিনি জার্মেনিয়াম টেট্রাক্লোরাইডের সাথে ডাইইথাইলজিংক-এর বিক্রিয়ায় টেট্রাইথাইলজার্মেন (Ge(C
2H
5)
4) উৎপন্ন করেন।[5] R4Ge ধরনের জৈব-জার্মেন (এখানে R হলো অ্যালকাইল) যেমন টেট্রামিথাইলজার্মেন (Ge(CH
3)
4) ও টেট্রাইথাইল জার্মেন সহজেই জার্মেনিয়াম যৌগ ও অ্যালকাইল নিউক্লিওফাইল থেকে উৎপন্ন করা যায়। জৈব জার্মেনিয়ামের হাইড্রাইড, যেমন আইসোবিউটাইলজার্মেন ((CH
3)
2CHCH
2GeH
3) এর ক্ষতিকর প্রভাব কম হওয়ায় অর্ধপরিবাহী তৈরিতে বিষাক্ত জার্মেন গ্যাসের পরিবর্তে তরল বিকল্প হিসেবে ব্যবহার করা যেতে পারে। বিভিন্ন সক্রিয় জার্মেনিয়াম অবস্থান্তর অবস্থা পাওয়া যায়, যেমন জার্মাইল মুক্ত রেডিকাল, জার্মালিন (কার্বিন-এর মতো) এবং জার্মাইন (কার্বাইন-এর মতো) প্রভৃতি।[41][42] ১৯৭০ সালে প্রথম জৈব-জার্মেনিয়াম যৌগ ২-কার্বক্সিইথাইলজার্মাসেসকুইঅক্সেন জ্ঞাপিত হয়। এটি কিছুদিন সুষম খাদ্যে বিকল্প হিসেবে ব্যবহৃত হয়। ধারণা করা হতো এটি দেহে পাথর-প্রতিরোধী।[43]
ইন্ড (১,১,৩,৩,৫,৫,৭,৭-অক্টাইথাইল-এস-হাইড্রিনডাকেন-৪-আইল) নামক একটি লিগ্যান্ড ব্যবহার করে জার্মেনিয়াম অক্সিজেনের সাথে দ্বিবন্ধন (জার্মানোন) গঠন করে।[44]
আইসোটোপ
জার্মেনিয়ামের ৫টি প্রাকৃতিক আইসোটোপ বিদ্যমান: 70
Ge
, 72
Ge
, 73
Ge
, 74
Ge
, এবং 76
Ge
। এর মধ্যে 76
Ge
খুব সামান্য পরিমাণে তেজষ্ক্রিয় ও দ্বি-বিটা ক্ষয়ের মাধ্যমে ক্ষয়প্রাপ্ত হয় এবং আইসোটোপের অর্ধায়ু প্রায় 1.78×১০21বছর। সবচেয়ে সাধারণ আইসোটোপ হলো 74
Ge
, প্রকৃতিতে যার প্রাপ্তির সম্ভাব্যতা ৩৬%। আবার 76
Ge
সবচেয়ে কম প্রাপ্য (প্রাকৃতিক প্রাপ্যতা প্রায় ৭%) আইসোটোপ।[45] আলফা কণা বিচ্ছুরণের ফলে 72
Ge
আইসোটোপ উচ্চ শক্তির ইলেকট্রন বিচ্ছুরিত হয় এবং অধিক স্থিতিশীল 77
Se
উৎপন্ন হয়।[46] এই কারণে নিউক্লীয় ব্যাটারিতে রেডনের সাথে আইসোটোপটি ব্যবহৃত হয়।[46]
এছাড়া আরোও ২৭টি তেজস্ক্রিয় আইসোটোপ তৈরি করা হয়েছে, যাদের পারমাণবিক ভর ৫৮ থেকে ৮৯। এর মধ্যে 68
Ge
আইসোটোপটি সবচেয়ে স্থিতিশীল, যার অর্ধায়ু ২৭০.৯৫ দিন এবং ইলেকট্রন ধারণের মাধ্যমে ক্ষয়প্রাপ্ত হয়। আবার সবচেয়ে কম স্থিতিশীল আইসোটোপ হলো 60
Ge
যার অর্ধায়ু মাত্র ৩০ মিলিসেকেন্ড। অধিকাংশ জার্মেনিয়াম আইসোটোপ বিটা ক্ষয়ের মাধ্যমে ক্ষয়প্রাপ্ত হয়। কিন্তু 61
Ge
ও 64
Ge
আইসোটোপ β+ ক্ষয়ের মাধ্যমে ক্ষয়প্রাপ্ত হয়।[45] 84
Ge
থেকে 87
Ge
আইসোটোপ সামান্য β- ক্ষয়ের প্রবণতা প্রদর্শন করে।[45]
প্রাপ্যতা
জার্মেনিয়াম তারায় নাক্ষত্রিক নিউক্লিওসংশ্লেষণ প্রক্রিয়ায় উৎপন্ন হয়, বিশেষত অসীম বৃহৎ শাখার নক্ষত্রে এস-প্রক্রিয়ায় উৎপন্ন হয়। এস-প্রসেস হলো স্পন্দনশীল লোহিত দানব নক্ষত্রের অভ্যন্তরে নিউট্রন গ্রহণের অতি ধীর একটি প্রক্রিয়া।[47] পৃথিবী থেকে দূরবর্তী তারা[48] ও বৃহস্পতির বায়ুমণ্ডলে জার্মেনিয়াম শনাক্ত করা হয়েছে।[49]
পৃথিবীপৃষ্ঠে জার্মেনিয়ামের প্রাপ্যতা প্রায় ১.৬ পিপিএম।[50] শুধুমাত্র আর্গাইরোডাইট, ব্রায়ারটাইট, জার্মানাইট ও রেনাইরাইট প্রভৃতি আকরিকে উল্লেখযোগ্য মাত্রায় জার্মেনিয়াম উপস্থিত থাকে।[23][51] এর মাত্র কয়েকটিতে (বিশেষত জার্মানাইট) উত্তোলনযোগ্য মাত্রায় জার্মেনিয়াম থাকে, তাও আবার খুবই দুর্লভ।[52][53][54] কিছু দস্তা-তামা-সীসা আকরিকে উল্লেখযোগ্য জার্মেনিয়াম থাকে যার সর্বশেষ নিষ্কাশিত বর্জ্য থেকে জার্মেনিয়াম পাওয়া যায়।[50] ভিক্টর মরিটজ গোল্ডস্মিট জার্মেনিয়াম খনির ওপর বিস্তারিত জরিপ করার সময় আবিষ্কার করেন যে কিছু প্রাকৃতিক ঘটনায় কয়লার খনিতে স্তরে স্তরে উচ্চ মাত্রার জার্মেনিয়াম সঞ্চিত হয়।[55][56] এ পর্যন্ত সবচেয়ে বেশি মাত্রার (১.৬%) জার্মেনিয়াম পাওয়া গেছে হার্টলি কয়লার ছাইয়ে।[55][56] ধারণা করা হয় অন্তর্দেশীয় মঙ্গোলিয়ার জিলিনহাওতের পাশের কয়লা খনিতে প্রায় ১৬০০ টন জার্মেনিয়াম মজুদ আছে।[50]
উৎপাদন
২০১১ সালে বিশ্বব্যাপী প্রায় ১১৮ টন জার্মেনিয়াম উৎপাদিত হয়, যার অধিকাংশ চীন (৮০ টন), রাশিয়া (৫ টন) এবং যুক্তরাষ্ট্রে (৩ টন) উৎপন্ন হয়।[23] স্ফ্যালেরাইট দস্তা আকরিক থেকে সহ-উৎপাদ হিসেবে জার্মেনিয়াম উৎপাদিত হয়। এই আকরিকে প্রায় ০.৩% পর্যন্ত জার্মেনিয়াম মৌল থাকে।[57] বিশেষত নিম্ন তাপমাত্রায় পাললিক Zn–Pb–Cu(–Ba) খনিতে এবং কার্বনেট-ভিত্তিক Zn–Pb খনিতে পাওয়া যায়।[58] সাম্প্রতিক গবেষণায় দেখা গেছে সন্ধানপ্রাপ্ত দস্তা আকরিকে বিশেষত মিসিসিপি উপত্যকার মতো খনিতে প্রায় ১০,০০০ টন ও কয়লে খনিতে ১,১২,০০০ টন উত্তোলনযোগ্য জের্মেনিয়াম মজুদ আছে।[59][60] ২০০৭ সালে মোট ব্যবহৃত জার্মেনিয়ামের ৩৫% পুনঃপ্রক্রিয়াজাতকৃত।[50]
| বছর | খরচ ($/কেজি)[61] |
|---|---|
| ১৯৯৯ | ১,৪০০ |
| ২০০০ | ১,২৫০ |
| ২০০১ | ৮৯০ |
| ২০০২ | ৬২০ |
| ২০০৩ | ৩৮০ |
| ২০০৪ | ৬০০ |
| ২০০৫ | ৬৬০ |
| ২০০৬ | ৮৮০ |
| ২০০৭ | ১,২৪০ |
| ২০০৮ | ১,৪৯০ |
| ২০০৯ | ৯৫০ |
| ২০১০ | ৯৪০ |
| ২০১১ | ১,৬২৫ |
| ২০১২ | ১,৬৮০ |
| ২০১৩ | ১,৮৭৫ |
| ২০১৪ | ১,৯০০ |
| ২০১৫ | ১,৭৬০ |
| ২০১৬ | ৯৫০ |
প্রধানত স্ফ্যালেরাইট থেকে উৎপাদিত হলেও রূপা, সীসা, এবং তামার আকরিকেও জার্মেনিয়াম পাওয়া যায়। জার্মেনিয়ামের আরেকটি উৎস হলো জার্মেনিয়ামসমৃদ্ধ কয়লা চালিত বিদ্যুৎ উৎপাদনকেন্দ্রের ভাসমান ছাই। রাশিয়া ও চীন মূলত এটিকে জার্মেনিয়ামের উৎস হিসেবে বিবেচনা করে থাকে।[62] রাশিয়ার খনিগুলোর অবস্থান দূরপ্রাচ্যের শাখালিন দ্বীপে ও ভ্লাদিভস্টকের উত্তর-পূর্বে। চীনের জার্মেনিয়াম খনির অবস্থান মূলত ইউনানের লিনচ্যাং-এর নিকট লিগনাইট খনিতে এবং অন্তর্দেশীয় মঙ্গোলিয়ার জিলিনহাউতের নিকট কয়লা খনিতে।[50]
আকরিকগুলো মূলত সালফাইডিক; বায়ুর উপস্থিতিতে উত্তপ্ত করে তা অক্সাইডে পরিণত করা হয়:
- GeS2 + 3 O2 → GeO2 + 2 SO2
এ প্রক্রিয়ায় উৎপাদিত বর্জ্যে কিছু পরিমাণ জার্মেনিয়াম অবশিষ্ট থাকে। বাকি অংশটুকু জার্মানেটে পরিণত করা হয়। অঙ্গারের জার্মানেটকে দস্তার সাথে সালফিউরিক এসিড দ্বারা পরিস্রুত করা হয়। প্রশমিত হওয়ার পর দ্রবণে শুধুমাত্র দস্তা উপস্থিত থাকে এবং জার্মেনিয়ামসহ অন্যান্য ধাতু অধঃক্ষিপ্ত হয়। ওয়েলজ প্রক্রিয়ায় অধঃক্ষেপ থেকে সামান্য দস্তা অপসারণের পর ওয়েলজ অক্সিডকে দ্বিতীয়বারের মতো পরিস্রুত করা হয়। জার্মেনিয়াম ডাইঅক্সাইড অধঃক্ষেপ হিসেবে আহরিত হয় এবং ক্লোরিন গ্যাস কিংবা হাইড্রোক্লোরিক এসিডের উপস্থিতিতে জার্মেনিয়াম টেট্রাক্লোরাইডে পরিণত করা হয়। এই যৌগটি নিম্ন গলনাঙ্কবিশিষ্ট এবং পাতন প্রক্রিয়ায় আলাদা করা হয়:[62]
- GeO2 + 4 HCl → GeCl4 + 2 H2O
- GeO2 + 2 Cl2 → GeCl4 + O2
জার্মেনিয়াম টেট্রাক্লোরাইডকে অক্সাইডের (GeO2) সাথে আর্দ্রবিশ্লেষিত করা হয় অথবা আংশিক পাতন করে পরে আর্দ্রবিশ্লেষণ করা হয়।[62] উৎপন্ন বিশুদ্ধ GeO2 জার্মেনিয়াম কাচ তৈরির জন্য উপযুক্ত। একে হাইড্রোজেন দ্বারা বিজারিত করা হয় এবং উৎপন্ন জার্মেনিয়াম দ্বারা অবলোহিত আলোক যন্ত্রে এবং অর্ধপরিবাহী তৈরি হয়:
- GeO2 + 2 H2 → Ge + 2 H2O
ইস্পাত ও অন্যান্য শিল্পে ব্যবহৃত জার্মেনিয়ামের জন্য সাধারণত কার্বন দ্বারা বিজারিত করা হয়:[63]
- GeO2 + C → Ge + CO2
ব্যবহার
২০০৭ সালে পৃথিবীব্যাপী জার্মেনিয়ামের একটি বড় অংশ ব্যবহৃত হয়: ৩৫% অপটিক্যাল ফাইবার, ৩০% অবলোহিত আলোকবিজ্ঞান, ১৫% পলিমারকরণ বিক্রিয়ার প্রভাবক ও ১৫% ইলেকট্রনিক্স ও সৌরবিদ্যুৎ উৎপাদনে ব্যবহৃত হয়।[23] অবশিষ্ট ৫% অন্যান্য ক্ষেত্রে যেমন ফসফর, ধাতুবিদ্যা ও কেমোথেরাপি প্রভৃতিতে ব্যয়িত হয়।[23]
আলোকবিজ্ঞান
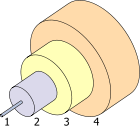
1. অভ্যন্তর ৮ µm
2. ক্ল্যাডিং ১২৫ µm
3. বাফার ২৫০ µm
4. জ্যাকেট ৪০০ µm
জার্মেনিয়ার (GeO2) একটি গুরুত্বপূর্ণ বৈশিষ্ট্য হলো এর উচ্চ প্রতিসরণাঙ্ক এবং নিম্ন বিচ্ছুরণ প্রবণতা। এই বৈশিষ্ট্যের জন্য একে ক্যামেরার ওয়াইড অ্যাঙ্গেল লেন্স, অণুবীক্ষণ যন্ত্র, এবং অপটিক্যাল ফাইবারের মজ্জা তৈরিতে ব্যবহার করা হয়।[64][65] সিলিকা তন্তুতে বর্তমানে ভেজাল (ডোপেন্ট) হিসেবে টাইটানিয়ার পরিবর্তে এটি ব্যবহৃত হয়। ফলে তন্তুটির তাপ প্রদানে ভেঙ্গে যাওয়ার প্রবণতা হ্রাস পায়।[66] ২০০২ এর শেষ পর্যন্ত যুক্তরাষ্ট্রে মোট ব্যবহৃত জার্মেনিয়ামের ৬০% অপটিক্যাল ফাইবার তৈরিতে ব্যয়িত হয়, তবে বৈশ্বিক ব্যবহারের মাত্র ১০% এ ক্ষেত্রে ব্যয় হয়।[65] GeSbTe একটি দশা-পরিবর্তী পদার্থ, যা এর আলোক ধর্মের জন্য ব্যবহৃত হয়। পুনর্লিখনযোগ্য ডিভিডিতে এটি ব্যবহৃত হয়।[67]
অবলোহিত তরঙ্গদৈর্ঘ্যে যেহেতু জার্মেনিয়াম প্রায় স্বচ্ছ পদার্থের মতো আচরণ করে, তাই অবলোহিত আলোকবিজ্ঞানে এটিকে কেটে ও মসৃণ করে লেন্স ও জানালার কাচ হিসেবে ব্যবহার করা হয়। এটি ৮ থেকে ১৪ মাইক্রন সীমানায় কাজ করার জন্য থার্মাল ইমেজিং ক্যামেরার সম্মুখ লেন্সে, সেনাবাহিনীতে উষ্ণবস্তু-শনাক্তরণে, মোবাইলের নাইট ভিশন ও অগ্নিনির্বাপনের ক্ষেত্রে ব্যবহৃত হয়।[63] এটি অবলোহিত বর্ণালীবীক্ষণ ও অন্যান্য আলোক সরঞ্জামে ব্যবহৃত হয়, যেখানে অত্যন্ত সংবেদনশীল অবলোহিত শনাক্তকারক প্রয়োজন হয়।[65] এর উচ্চ প্রতিসরণাঙ্ক (৪.০) বিদ্যমান এবং প্রতিফলন-প্রতিরোধক দ্বারা আবৃত করে রাখা হয়। বিশেষত একটি বিশেষ শক্ত হীরক-সদৃশ কার্বন (ডিএলসি; প্রতিসরণাঙ্ক ২.০) এর আবরণ এর সাথে বেশ মানানসই এবং হীরার মতো শক্ত এমন একটি আবরণ তৈরি করে যা প্রাকৃতিক প্রতিকূলতা প্রতিরোধ করতে পারে।[68][69]
ইলেকট্রনিক্স
উচ্চগতির সমন্বিত বর্তনীর জন্য সিলিকন-জার্মেনিয়াম খুব দ্রুত একটি গুরুত্বপূর্ণ অর্ধপরিবাহী হিসেবে পরিচিতি লাভ করছে। শুধুমাত্র সিলিকন ব্যবহার করে তৈরি করা বর্তনীর তুলনার Si-SiGe সংযোগের বৈশিষ্টাবলি ব্যবহার করে তৈরি করা বর্তনী অত্যন্ত দ্রুত কাজ করে।[70] সিলিকন-জার্মেনিয়াম বেতার যোগাযোগ যন্ত্রে গ্যালিয়াম আর্সেনাইডের (GaAs) স্থান দখল করে নিচ্ছে।[23] সিলিকন চিপস শিল্পে উচ্চগতিসম্পন্ন SiGe চিপস অপেক্ষাকৃত কম খরচে নির্মাণ করা যায়।[23]
জার্মেনিয়ামের আরেকটি গুরুত্বপূর্ণ ব্যবহার সৌর কোষ তৈরি। মহাকাশযানে ব্যবহৃত উচ্চ-ক্ষমতার বহু-সংযোগযুক্ত ফটোভোল্টেইক কোষের বিস্কুটগুলোর সাবস্ট্রেট হিসেবে জার্মেনিয়াম ব্যবহৃত হয়। যানবাহনের হেডলাইট ও ব্যাকলাইট এলসিডি স্ক্রিনে ব্যবহৃত উচ্চমাত্রার উজ্জ্বল এলইডি হলো জার্মেনিয়ামের আরেকটি গুরুত্বপূর্ণ ব্যবহার।[23]
জার্মেনিয়াম ও গ্যালিয়াম আর্সেনাইডের কেলাসন ধ্রুবক প্রায় সমান হওয়ায় গ্যালিয়াম আর্সেনাইড সৌরকোষ তৈরিতে জার্মেনিয়াম সাবস্ট্রেট ব্যবহৃত হতে পারে।[71] মঙ্গল গবেষণা রোভারযান ও বিভিন্ন কৃত্রিম উপগ্রহে জার্মেনিয়াম কোষের ওপর গ্যালিয়াম আর্সেনাইডের ত্রি-সংযোগ ব্যবহার করা হয়েছে।[72]
ক্ষুদ্র চিপে সিলিকনের পরিবর্তে জার্মেনিয়াম-অন-ইনসুলেটর (GeOI) সাবস্ট্রেট হিসেবে ব্যবহার করতে দেখা যায়।[23] GeOI সাবস্ট্রেটভিত্তিক সিএমওএস বর্তনী সম্প্রতিই তৈরি করা হয়েছে।[73] ইলেকট্রনিক্স ক্ষেত্রে এর আরেকটি গুরুত্বপূর্ণ ব্যবহার হলো ফ্লুরোসেন্ট বাতির ফসফরে[28] এবং কঠিন অবস্থায় লাইট ইমিটিং ডায়োডে (এলইডি)।[23] রক এন রোল যুগ থেকে এখন পর্যন্ত সংগীতশিল্পীদের দ্বারা জার্মেনিয়াম ট্রানজিস্টরের ব্যবহার হয়ে আসছে, যারা ফাজ টোনে একটি স্বতন্ত্র বৈশিষ্ট্য যোগ করতে চান, বিশেষত ডালাস আর্বিটার ফাজ ফেসে।[74]
অন্যান্য ব্যবহার
পলিইথিলিন টেট্রাফথেলেট (পিইটি) তৈরির জন্য পলিমারকরণ বিক্রিয়ায় জার্মেনিয়াম ডাইঅক্সাইড প্রভাবক হিসেবে কাজ করে।[75] এই ধরনের পলিএস্টারের বিশেষ উজ্জ্বলতার জন্য জাপানে বিশেষভাবে পেট বা পিইটি বোতল বাজারজাত করা হয়।[75] তবে যুক্তরাষ্ট্রে পলিমারকরণ প্রভাবক হিসেবে জার্মেনিয়াম ব্যবহৃত হয় না।[23]
সিলিকা (SiO2) ও জার্মেনিয়াম ডাইঅক্সাইডের সাদৃশ্যের কারণে (GeO2) কোনো কোনো গ্যাস ক্রোমাটোগ্রাফি কলামে স্থির দশা হিসেবে, সিলিকার পরিবর্তে GeO2 ব্যবহৃত হতে পারে।[76]
সাম্প্রতিক বছরগুলোতে দামি সংকর ধাতু তৈরিতে জার্মেনিয়ামের ব্যবহার বৃদ্ধি পাচ্ছে। যেমন স্টার্লিং রূপার সংকরে জার্মেনিয়াম অগ্নিছোপ প্রতিরোধ করে, মরিচা প্রতিরোধক্ষমতা বৃদ্ধি করে এবং ধাতুকে শক্তিশালী করে। বাণিজ্যিকভাবে আর্জেন্টিয়াম নামে পরিচিত মরিচা-প্রতিরোধী রৌপ্য সংকরে প্রায় ১.২% জার্মেনিয়াম ধারণ করে।[23]
একক স্ফটিক উচ্চমাত্রার বিশুদ্ধ জার্মেনিয়াম নির্মিত অর্ধপরিবাহী শনাক্তকারক অত্যন্ত সঠিকভাবে তেজস্ক্রিয় রশ্মি শনাক্ত করতে পারায় বিমানবন্দর নিরাপত্তায় ব্যবহৃত হয়।[77] একক স্ফটিক নিউট্রন বিকিরণ ও সিনক্রোটন এক্স রশ্মি বিকিরণের আলোকরশ্মির ক্ষেত্রে জার্মেনিয়াম বেশ কার্যকরী। সিলিকনের তুলনায় এর প্রতিবিম্বন ক্ষমতা নিউট্রন ও উচ্চ শক্তির এক্স রশ্মির ওপর অধিক কার্যকরী। [78] গামা বর্ণালি শনাক্তকরণ ও কৃষ্ণবস্তু অনুসন্ধান যন্ত্রে উচ্চ মাত্রার বিশুদ্ধ জার্মেনিয়াম স্ফটিক ব্যবহৃত হয়।[79] এছাড়া ফসফরাস, ক্লোরিন ও সালফার শনাক্তকরণে এক্স রশ্মি বর্ণালীবীক্ষণ যন্ত্রে জার্মেনিয়াম স্ফটিক ব্যবহৃত হয়।[80]
স্পিনট্রনিক্স ও ঘূর্ণন-নির্ভর কোয়ান্টাম গণনার ক্ষেত্রে জার্মেনিয়াম একটি গুরুত্বপূর্ণ মৌল হিসেবে বিবেচিত হচ্ছে। বিজ্ঞানীরা ২০১০ সালে কক্ষ তাপমাত্রায় ঘূর্ণন পরিবহন[81] ও সাম্প্রতিককালে জার্মেনিয়ামের দাতা ইলেকট্রন ঘূর্ণন পর্যবেক্ষণ করে দীর্ঘ সংলগ্ন কাল দেখতে পান।[82]
স্বাস্থ্যের ওপর প্রতিক্রিয়া
জার্মেনিয়ামকে উদ্ভিদ অথবা প্রাণির স্বাস্থ্যের জন্য অত্যাবশ্যকীয় মৌল হিসেবে বিবেচনা করা হয় না।[83] স্বাস্থ্যের ওপর প্রকৃতিকে মুক্ত জার্মেনিয়ামের প্রভাব প্রায় নেই বললেই চলে। তবে এটি একটি প্রাথমিক ধারণা কেননা মৌলটি শুধুমাত্র খনিতে ও কার্বনযুক্ত পদার্থে অন্য মৌলের নির্দেশক হিসেবে থাকে এবং বিভিন্ন শিল্প ও ইলেকট্রনিক্সে খুবই সামান্য পরিমাণে ব্যবহার হয়, যার সাধারণত মুখে যাওয়ার সম্ভাবনা নেই বললেই চলে।[23] একই কারণে জৈব-দূষক হিসেবে সর্বশেষ স্তরের জার্মেনিয়ামের প্রকৃতির ওপর প্রভাব প্রায় নেই বললেই চলে। তবে জার্মেনিয়ামের কিছু সক্রিয় মধ্যবর্তী যৌগ বিষাক্ত (নিচের সতর্কতা অংশ দ্রষ্টব্য)।[84]
জৈব ও অজৈব জার্মেনিয়াম যৌগ থেকে সৃষ্ট জার্মেনিয়াম সম্পূরক যৌগ লিউকেমিয়া ও ফুসফুসের ক্যান্সারের চিকিৎসায় ব্যবহারযোগ্য বিকল্প ওষুধ হিসেবে বাজারজাত করা হচ্ছে।[20] যদিও এর কোনো প্রতিষ্ঠিত প্রমাণ পাওয়া যায় না, আবার কোনো কোনো গবেষক এটিকে অত্যন্ত ক্ষতিকারক হিসেবে আখ্যায়িত করেন।[83]
কিছু কিছু জার্মেনিয়াম যৌগকে ডাক্তাররা এফডিএ অস্বীকৃত প্রবেশযোগ্য দ্রবণ হিসেবে ব্যাখ্যা করেন। প্রথম দিকে ব্যবহৃত দ্রবণীয় অজৈব জার্মেনিয়াম যৌগ, বিশেষত সাইট্রেট-ল্যাকটেট লবণ, দীর্ঘদিন ব্যবহারের ফলে বৃক্কের ত্রুটি, হেপাটিক স্টিটোসিস ও প্যারিফেরাল নিউরোপ্যাথি প্রভৃতি জটিলতা সৃষ্টি করে। রক্তরস ও মূত্রে জার্মেনিয়ামের ঘনমাত্রা বেড়ে অনেকে মৃত্যুবরণ করেন, অনেকে বিভিন্ন মাত্রায় এন্ডোজেনসংক্রান্ত জটিলতায় আক্রান্ত হন। আরো সাম্প্রতিক জৈব যৌগ, বিটা-কার্বক্সিইথাইলজার্মেনিয়াম সেসকুইঅক্সাইড (প্রপাজার্মেনিয়াম) বিষাক্ততায় একই বর্ণালী প্রদর্শন করে না।[85]
যুক্তরাষ্ট্রের খাদ্য ও ঔষধ প্রশাসন কর্তৃপক্ষ গবেষণার মাধ্যমে সিদ্ধান্তে পৌঁছায় যে পৌষ্টিক বিকল্প হিসেবে অজৈব জার্মেনিয়াম গৃহীত হলে তা স্বাস্থ্যের জন্য সম্ভাব্য ক্ষতির কারণ হতে পারে।[43]
কিছু জার্মেনিয়াম যৌগ স্তন্যপায়ীর দেহে কম বিষাক্ততা প্রদর্শন করলেও কিছু ব্যাকটেরিয়া দেহে মারাত্মক বিষাক্ত প্রভাব সৃষ্টি করে।[25]
রাসায়নিক সক্রিয় জার্মেনিয়াম যৌগের জন্য সতর্কতা
কৃত্রিমভাবে উৎপাদিত বেশ কিছু জার্মেনিয়াম যৌগ বেশ সক্রিয় এবং মানবস্বাস্থ্যে তাৎক্ষণিকভাবে ক্ষতিকর প্রভাব সৃষ্টি করে। উদাহরণস্বরূপ, জার্মেনিয়াম টেট্রাক্লোরাইড এবং জার্মেন (GeH4), যা যথাক্রমে তরল ও গ্যাসীয় পদার্থ, মানবদেহের চোখ, ত্বক, ফুসফুস এবং গলায় প্রদাহ সৃষ্টি করে।[86]
আরও দেখুন
- ভাইব্রেনিয়াম
- নাইওবিয়াম
তথ্যসূত্র
- Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- "Properties of Germanium"। Ioffe Institute।
- Kaji, Masanori (২০০২)। "D. I. Mendeleev's concept of chemical elements and The Principles of Chemistry" (PDF)। Bulletin for the History of Chemistry। 27 (1): 4–16। ২০০৮-১২-১৭ তারিখে মূল (PDF) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০০৮-০৮-২০।
- Argyrodite – Ag
8GeS
6 (PDF) (প্রতিবেদন)। Mineral Data Publishing। সংগ্রহের তারিখ ২০০৮-০৯-০১। - Winkler, Clemens (১৮৮৭)। "Mittheilungen über des Germanium. Zweite Abhandlung"। J. Prak. Chemie (জার্মান ভাষায়)। 36 (1): 177–209। doi:10.1002/prac.18870360119। সংগ্রহের তারিখ ২০০৮-০৮-২০।
- Winkler, Clemens (১৮৮৭)। "Germanium, Ge, a New Nonmetal Element"। Berichte der Deutschen Chemischen Gesellschaft (জার্মান ভাষায়)। 19 (1): 210–211। doi:10.1002/cber.18860190156। ডিসেম্বর ৭, ২০০৮ তারিখে মূল থেকে আর্কাইভ করা।
- Adams, J. C. (নভেম্বর ১৩, ১৮৪৬)। "Explanation of the observed irregularities in the motion of Uranus, on the hypothesis of disturbance by a more distant planet"। Monthly Notices of the Royal Astronomical Society। 7 (9): 149–152। doi:10.1093/mnras/7.9.149। বিবকোড:1846MNRAS...7..149A।
- Challis, Rev. J. (নভেম্বর ১৩, ১৮৪৬)। "Account of observations at the Cambridge observatory for detecting the planet exterior to Uranus"। Monthly Notices of the Royal Astronomical Society। 7 (9): 145–149। doi:10.1093/mnras/7.9.145। বিবকোড:1846MNRAS...7..145C।
- Sears, Robert (জুলাই ১৮৭৭)। Scientific Miscellany। The Galaxy। 24। পৃষ্ঠা 131। আইএসবিএন 978-0-665-50166-1। ওসিএলসি 16890343।
- "Editor's Scientific Record"। Harper's New Monthly Magazine। 55 (325): 152–153। জুন ১৮৭৭।
- van der Krogt, Peter। "Elementymology & Elements Multidict: Niobium"। সংগ্রহের তারিখ ২০০৮-০৮-২০।
- Westgren, A. (১৯৬৪)। "The Nobel Prize in Chemistry 1951: presentation speech"। Nobel Lectures, Chemistry 1942–1962। Elsevier।
- "Germanium, a New Non-Metallic Element"। The Manufacturer and Builder: 181। ১৮৮৭। সংগ্রহের তারিখ ২০০৮-০৮-২০।
- Brunck, O. (১৮৮৬)। "Obituary: Clemens Winkler"। Berichte der Deutschen Chemischen Gesellschaft (জার্মান ভাষায়)। 39 (4): 4491–4548। doi:10.1002/cber.190603904164।
- de Boisbaudran, M. Lecoq (১৮৮৬)। "Sur le poids atomique du germanium"। Comptes Rendus (ফরাসি ভাষায়)। 103: 452। সংগ্রহের তারিখ ২০০৮-০৮-২০।
- Haller, E. E. (২০০৬-০৬-১৪)। "Germanium: From Its Discovery to SiGe Devices" (PDF)। Department of Materials Science and Engineering, University of California, Berkeley, and Materials Sciences Division, Lawrence Berkeley National Laboratory, Berkeley। সংগ্রহের তারিখ ২০০৮-০৮-২২।
- W. K. (১৯৫৩-০৫-১০)। "Germanium for Electronic Devices"। The New York Times। সংগ্রহের তারিখ ২০০৮-০৮-২২।
- "1941 – Semiconductor diode rectifiers serve in WW II"। Computer History Museum। সংগ্রহের তারিখ ২০০৮-০৮-২২।
- "SiGe History"। University of Cambridge। ২০০৮-০৮-০৫ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০০৮-০৮-২২।
- Halford, Bethany (২০০৩)। "Germanium"। Chemical & Engineering News। American Chemical Society। সংগ্রহের তারিখ ২০০৮-০৮-২২।
- Bardeen, J.; Brattain, W. H. (১৯৪৮)। "The Transistor, A Semi-Conductor Triode"। Physical Review। 74 (2): 230–231। doi:10.1103/PhysRev.74.230। বিবকোড:1948PhRv...74..230B।
- "Electronics History 4 – Transistors"। National Academy of Engineering। সংগ্রহের তারিখ ২০০৮-০৮-২২।
- U.S. Geological Survey (২০০৮)। "Germanium – Statistics and Information"। U.S. Geological Survey, Mineral Commodity Summaries। সংগ্রহের তারিখ ২০০৮-০৮-২৮।
Select 2008
- Teal, Gordon K. (জুলাই ১৯৭৬)। "Single Crystals of Germanium and Silicon-Basic to the Transistor and Integrated Circuit"। IEEE Transactions on Electron Devices। ED-23 (7): 621–639। doi:10.1109/T-ED.1976.18464। বিবকোড:1976ITED...23..621T।
- Emsley, John (২০০১)। Nature's Building Blocks। Oxford: Oxford University Press। পৃষ্ঠা 506–510। আইএসবিএন 978-0-19-850341-5।
- Agnese, R.; Aralis, T.; Aramaki, T.; Arnquist, I. J.; Azadbakht, E.; Baker, W.; Banik, S.; Barker, D.; Bauer, D. A. (২০১৮-০৮-২৭)। "Energy loss due to defect formation from 206Pb recoils in SuperCDMS germanium detectors"। Applied Physics Letters। 113 (9): 092101। arXiv:1805.09942

- Holleman, A. F.; Wiberg, E.; Wiberg, N. (২০০৭)। Lehrbuch der Anorganischen Chemie (102nd সংস্করণ)। de Gruyter। আইএসবিএন 978-3-11-017770-1। ওসিএলসি 145623740।
- "Germanium"। Los Alamos National Laboratory। সংগ্রহের তারিখ ২০০৮-০৮-২৮।
- Chardin, B. (২০০১)। "Dark Matter: Direct Detection"। Binetruy, B। The Primordial Universe: 28 June – 23 July 1999। Springer। পৃষ্ঠা 308। আইএসবিএন 978-3-540-41046-1।
- Lévy, F.; Sheikin, I.; Grenier, B.; Huxley, A. (আগস্ট ২০০৫)। "Magnetic field-induced superconductivity in the ferromagnet URhGe"। Science। 309 (5739): 1343–1346। doi:10.1126/science.1115498। PMID 16123293। বিবকোড:2005Sci...309.1343L।
- Tabet, N; Salim, Mushtaq A. (১৯৯৮)। "KRXPS study of the oxidation of Ge(001) surface"। Applied Surface Science। 134 (1–4): 275–282। doi:10.1016/S0169-4332(98)00251-7। বিবকোড:1998ApSS..134..275T।
- Greenwood, N. N.; Earnshaw, A. (১৯৯৭)। Chemistry of the Elements (2nd সংস্করণ)। Butterworth-Heinemann। আইএসবিএন 0080379419।
- Tabet, N; Salim, M. A.; Al-Oteibi, A. L. (১৯৯৯)। "XPS study of the growth kinetics of thin films obtained by thermal oxidation of germanium substrates"। Journal of Electron Spectroscopy and Related Phenomena। 101–103: 233–238। doi:10.1016/S0368-2048(98)00451-4।
- Xu, Li; Sevov, Slavi C. (১৯৯৯)। "Oxidative Coupling of Deltahedral [Ge9]4− Zintl Ions"। J. Am. Chem. Soc.। 121 (39): 9245–9246। doi:10.1021/ja992269s।
- Bayya, Shyam S.; Sanghera, Jasbinder S.; Aggarwal, Ishwar D.; Wojcik, Joshua A. (২০০২)। "Infrared Transparent Germanate Glass-Ceramics"। Journal of the American Ceramic Society। 85 (12): 3114–3116। doi:10.1111/j.1151-2916.2002.tb00594.x।
- Drugoveiko, O. P.; Evstrop'ev, K. K.; Kondrat'eva, B. S.; Petrov, Yu. A.; Shevyakov, A. M. (১৯৭৫)। "Infrared reflectance and transmission spectra of germanium dioxide and its hydrolysis products"। Journal of Applied Spectroscopy। 22 (2): 191–193। doi:10.1007/BF00614256। বিবকোড:1975JApSp..22..191D।
- Lightstone, A. W.; McIntyre, R. J.; Lecomte, R.; Schmitt, D. (১৯৮৬)। "A Bismuth Germanate-Avalanche Photodiode Module Designed for Use in High Resolution Positron Emission Tomography"। IEEE Transactions on Nuclear Science। 33 (1): 456–459। doi:10.1109/TNS.1986.4337142। বিবকোড:1986ITNS...33..456L।
- Johnson, Otto H. (১৯৫২)। "Germanium and its Inorganic Compounds"। Chem. Rev.। 51 (3): 431–469। doi:10.1021/cr60160a002।
- Fröba, Michael; Oberender, Nadine (১৯৯৭)। "First synthesis of mesostructured thiogermanates"। Chemical Communications (18): 1729–1730। doi:10.1039/a703634e।
- Beattie, I.R.; Jones, P.J.; Reid, G.; Webster, M. (১৯৯৮)। "The Crystal Structure and Raman Spectrum of Ge5Cl12·GeCl4 and the Vibrational Spectrum of Ge2Cl6"। Inorg. Chem.। 37 (23): 6032–6034। doi:10.1021/ic9807341। PMID 11670739।
- Satge, Jacques (১৯৮৪)। "Reactive intermediates in organogermanium chemistry"। Pure Appl. Chem.। 56 (1): 137–150। doi:10.1351/pac198456010137।
- Quane, Denis; Bottei, Rudolph S. (১৯৬৩)। "Organogermanium Chemistry"। Chemical Reviews। 63 (4): 403–442। doi:10.1021/cr60224a004।
- Tao, S. H.; Bolger, P. M. (জুন ১৯৯৭)। "Hazard Assessment of Germanium Supplements"। Regulatory Toxicology and Pharmacology। 25 (3): 211–219। doi:10.1006/rtph.1997.1098। PMID 9237323।
- Broadwith, Phillip (২৫ মার্চ ২০১২)। "Germanium-oxygen double bond takes centre stage"। Chemistry World। সংগ্রহের তারিখ ২০১৪-০৫-১৫।
- টেমপ্লেট:NUBASE 2003
- Perreault, Bruce A. "Alpha Fusion Electrical Energy Valve", US Patent 7800286, issued September 21, 2010. ওয়েব্যাক মেশিনে আর্কাইভকৃত অক্টোবর ১২, ২০০৭ তারিখে
- Sterling, N. C.; Dinerstein, Harriet L.; Bowers, Charles W. (২০০২)। "Discovery of Enhanced Germanium Abundances in Planetary Nebulae with the Far Ultraviolet Spectroscopic Explorer"। The Astrophysical Journal Letters। 578 (1): L55–L58। arXiv:astro-ph/0208516

- Cowan, John (২০০৩-০৫-০১)। "Astronomy: Elements of surprise"। Nature। 423 (29): 29। doi:10.1038/423029a। PMID 12721614। বিবকোড:2003Natur.423...29C।
- Kunde, V.; Hanel, R.; Maguire, W.; Gautier, D.; Baluteau, J. P.; Marten, A.; Chedin, A.; Husson, N.; Scott, N. (১৯৮২)। "The tropospheric gas composition of Jupiter's north equatorial belt /NH3, PH3, CH3D, GeH4, H2O/ and the Jovian D/H isotopic ratio"। Astrophysical Journal। 263: 443–467। doi:10.1086/160516। বিবকোড:1982ApJ...263..443K।
- Höll, R.; Kling, M.; Schroll, E. (২০০৭)। "Metallogenesis of germanium – A review"। Ore Geology Reviews। 30 (3–4): 145–180। doi:10.1016/j.oregeorev.2005.07.034।
- Frenzel, Max (২০১৬)। "The distribution of gallium, germanium and indium in conventional and non-conventional resources – Implications for global availability (PDF Download Available)"। ResearchGate। Unpublished। doi:10.13140/rg.2.2.20956.18564। সংগ্রহের তারিখ ২০১৭-০৬-১০।
- Roberts, Andrew C.; ও অন্যান্য (ডিসেম্বর ২০০৪)। "Eyselite, Fe3+Ge34+O7(OH), a new mineral species from Tsumeb, Namibia"। The Canadian Mineralogist। 42 (6): 1771–1776। doi:10.2113/gscanmin.42.6.1771।
- https://www.deutsche-rohstoffagentur.de/DERA/DE/Downloads/vortrag_germanium.pdf?__blob=publicationFile&v=2
- http://tupa.gtk.fi/raportti/arkisto/070_peh_76.pdf
- Goldschmidt, V. M. (১৯৩০)। "Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten"। Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167।
- Goldschmidt, V. M.; Peters, Cl. (১৯৩৩)। "Zur Geochemie des Germaniums"। Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167।
- Bernstein, L (১৯৮৫)। "Germanium geochemistry and mineralogy"। Geochimica et Cosmochimica Acta। 49 (11): 2409–2422। doi:10.1016/0016-7037(85)90241-8। বিবকোড:1985GeCoA..49.2409B।
- Frenzel, Max; Hirsch, Tamino; Gutzmer, Jens (জুলাই ২০১৬)। "Gallium, germanium, indium and other minor and trace elements in sphalerite as a function of deposit type – A meta-analysis"। Ore Geology Reviews। 76: 52–78। doi:10.1016/j.oregeorev.2015.12.017।
- Frenzel, Max; Ketris, Marina P.; Gutzmer, Jens (২০১৩-১২-২৯)। "On the geological availability of germanium"। Mineralium Deposita। 49 (4): 471–486। doi:10.1007/s00126-013-0506-z। আইএসএসএন 0026-4598। বিবকোড:2014MinDe..49..471F।
- Frenzel, Max; Ketris, Marina P.; Gutzmer, Jens (২০১৪-০১-১৯)। "Erratum to: On the geological availability of germanium"। Mineralium Deposita। 49 (4): 487। doi:10.1007/s00126-014-0509-4। আইএসএসএন 0026-4598। বিবকোড:2014MinDe..49..487F।
- R.N. Soar (১৯৭৭)। USGS Minerals Information। U.S. Geological Survey Mineral Commodity Summaries। January 2003, January 2004, January 2005, January 2006, January 2007,January 2010। আইএসবিএন 978-0-85934-039-7। ওসিএলসি 16437701।
- Naumov, A. V. (২০০৭)। "World market of germanium and its prospects"। Russian Journal of Non-Ferrous Metals। 48 (4): 265–272। doi:10.3103/S1067821207040049।
- Moskalyk, R. R. (২০০৪)। "Review of germanium processing worldwide"। Minerals Engineering। 17 (3): 393–402। doi:10.1016/j.mineng.2003.11.014।
- Rieke, G. H. (২০০৭)। "Infrared Detector Arrays for Astronomy"। Annual Review of Astronomy and Astrophysics। 45 (1): 77–115। doi:10.1146/annurev.astro.44.051905.092436। বিবকোড:2007ARA&A..45...77R।
- Brown, Jr., Robert D. (২০০০)। "Germanium" (PDF)। U.S. Geological Survey। সংগ্রহের তারিখ ২০০৮-০৯-২২।
- "Chapter III: Optical Fiber For Communications" (PDF)। Stanford Research Institute। সংগ্রহের তারিখ ২০০৮-০৮-২২।
- "Understanding Recordable & Rewritable DVD" (PDF) (First সংস্করণ)। Optical Storage Technology Association (OSTA)। ২০০৯-০৪-১৯ তারিখে মূল (PDF) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০০৮-০৯-২২।
- Lettington, Alan H. (১৯৯৮)। "Applications of diamond-like carbon thin films"। Carbon। 36 (5–6): 555–560। doi:10.1016/S0008-6223(98)00062-1।
- Gardos, Michael N.; Bonnie L. Soriano; Steven H. Propst (১৯৯০)। Feldman, Albert; Holly, Sandor, সম্পাদকগণ। "Study on correlating rain erosion resistance with sliding abrasion resistance of DLC on germanium"। Proc. SPIE। SPIE Proceedings। 1325 (Mechanical Properties): 99। doi:10.1117/12.22449। বিবকোড:1990SPIE.1325...99G।
- Washio, K. (২০০৩)। "SiGe HBT and BiCMOS technologies for optical transmission and wireless communication systems"। IEEE Transactions on Electron Devices। 50 (3): 656–668। doi:10.1109/TED.2003.810484। বিবকোড:2003ITED...50..656W।
- Bailey, Sheila G.; Raffaelle, Ryne; Emery, Keith (২০০২)। "Space and terrestrial photovoltaics: synergy and diversity"। Progress in Photovoltaics: Research and Applications। 10 (6): 399–406। doi:10.1002/pip.446। hdl:2060/20030000611।
- Crisp, D.; Pathare, A.; Ewell, R. C. (জানুয়ারি ২০০৪)। "The performance of gallium arsenide/germanium solar cells at the Martian surface"। Acta Astronautica। 54 (2): 83–101। doi:10.1016/S0094-5765(02)00287-4। বিবকোড:2004AcAau..54...83C।
- Wu, Heng; Ye, Peide D. (আগস্ট ২০১৬)। "Fully Depleted Ge CMOS Devices and Logic Circuits on Si" (PDF)। IEEE Transactions on Electron Devices। 63 (8): 3028–3035। doi:10.1109/TED.2016.2581203। বিবকোড:2016ITED...63.3028W।
- Szweda, Roy (২০০৫)। "Germanium phoenix"। III-Vs Review। 18 (7): 55। doi:10.1016/S0961-1290(05)71310-7।
- Thiele, Ulrich K. (২০০১)। "The Current Status of Catalysis and Catalyst Development for the Industrial Process of Poly(ethylene terephthalate) Polycondensation"। International Journal of Polymeric Materials। 50 (3): 387–394। doi:10.1080/00914030108035115।
- Fang, Li; Kulkarni, Sameer; Alhooshani, Khalid; Malik, Abdul (২০০৭)। "Germania-Based, Sol-Gel Hybrid Organic-Inorganic Coatings for Capillary Microextraction and Gas Chromatography"। Anal. Chem.। 79 (24): 9441–9451। doi:10.1021/ac071056f। PMID 17994707।
- Keyser, Ronald; Twomey, Timothy; Upp, Daniel। "Performance of Light-Weight, Battery-Operated, High Purity Germanium Detectors for Field Use" (PDF)। Oak Ridge Technical Enterprise Corporation (ORTEC)। অক্টোবর ২৬, ২০০৭ তারিখে মূল (PDF) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০০৮-০৯-০৬।
- Ahmed, F. U.; Yunus, S. M.; Kamal, I.; Begum, S.; Khan, Aysha A.; Ahsan, M. H.; Ahmad, A. A. Z. (১৯৯৬)। "Optimization of Germanium for Neutron Diffractometers"। International Journal of Modern Physics E। 5 (1): 131–151। doi:10.1142/S0218301396000062। বিবকোড:1996IJMPE...5..131A।
- Diehl, R.; Prantzos, N.; Vonballmoos, P. (২০০৬)। "Astrophysical constraints from gamma-ray spectroscopy"। Nuclear Physics A। 777 (2006): 70–97। arXiv:astro-ph/0502324


- Eugene P. Bertin (1970). Principles and practice of X-ray spectrometric analysis, Chapter 5.4 – Analyzer crystals, Table 5.1, p. 123; Plenum Press
- Shen, C.; Trypiniotis, T.; Lee, K. Y.; Holmes, S. N.; Mansell, R.; Husain, M.; Shah, V.; Li, X. V.; Kurebayashi, H. (২০১০-১০-১৮)। "Spin transport in germanium at room temperature" (PDF)। Applied Physics Letters। 97 (16): 162104। doi:10.1063/1.3505337। আইএসএসএন 0003-6951। বিবকোড:2010ApPhL..97p2104S।
- Sigillito, A. J.; Jock, R. M.; Tyryshkin, A. M.; Beeman, J. W.; Haller, E. E.; Itoh, K. M.; Lyon, S. A. (২০১৫-১২-০৭)। "Electron Spin Coherence of Shallow Donors in Natural and Isotopically Enriched Germanium"। Physical Review Letters। 115 (24): 247601। arXiv:1506.05767

- Ades TB, সম্পাদক (২০০৯)। "Germanium"। American Cancer Society Complete Guide to Complementary and Alternative Cancer Therapies (2nd সংস্করণ)। American Cancer Society। পৃষ্ঠা 360–363। আইএসবিএন 978-0944235713।
- Brown Jr., Robert D.। Commodity Survey:Germanium (PDF) (প্রতিবেদন)। US Geological Surveys। সংগ্রহের তারিখ ২০০৮-০৯-০৯।
- Baselt, R. (২০০৮)। Disposition of Toxic Drugs and Chemicals in Man (8th সংস্করণ)। Foster City, CA: Biomedical Publications। পৃষ্ঠা 693–694।
- Gerber, G. B.; Léonard, A. (১৯৯৭)। "Mutagenicity, carcinogenicity and teratogenicity of germanium compounds"। Regulatory Toxicology and Pharmacology। 387 (3): 141–146। doi:10.1016/S1383-5742(97)00034-3।