আর্গন
আর্গন একটি হল রাসায়নিক মৌল যার প্রতীক Ar এবং পারমাণবিক সংখ্যা ১৮। এটি পর্যায় সারণীর গ্রুপ ১৮ তে অবস্থিত একটি নিষ্ক্রিয় গ্যাস । [2] ০.৯৪৩% (৯৩৪০ ppmv ) উপস্থিতি নিয়ে আর্গন হল পৃথিবীর বায়ুমণ্ডলে তৃতীয় সর্বাধিক পরিমাণের গ্যাস। এর পরিমাণ জলীয় বাষ্পের দ্বিগুণেরও বেশি (যার গড় পরিমাণ প্রায় ৪০০০ ppmv), কার্বন ডাই অক্সাইড (৪০০ ppmv) এর চেয়ে ২৩ গুণ বেশি, এবং নিয়ন (১৮ ppmv) এর চেয়ে ৫০০ গুণ বেশি। আর্গন পৃথিবীর ভূত্বকের উপস্থিত নিষ্ক্রিয় গ্যাসসমূহের মধ্যে সবচেয়ে সুলভ, যেখানে এর উপস্থিতি ০.০০০১৫% ।
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Spectral lines of argon. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পরিচয় | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| নাম, প্রতীক | আর্গন, Ar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| উচ্চারণ | /ˈɑːrɡɒn/ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| উপস্থিতি | colorless gas exhibiting an lilac/violet glow when placed in a high voltage electric field | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পর্যায় সারণীতে আর্গন | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক সংখ্যা | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| আদর্শ পারমাণবিক ভর | 39.948(1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| মৌলের শ্রেণী | নিষ্ক্রিয় গ্যাস | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| শ্রেণী, পর্যায়, ব্লক | ১৮, পর্যায় 3, p-ব্লক | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ইলেকট্রন বিন্যাস | [Ne] 3s2 3p6 per shell: 2, 8, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ভৌত বৈশিষ্ট্য | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| দশা | গ্যাস | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| গলনাঙ্ক | 83.80 কে (−189.35 °সে, −308.83 °ফা) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| স্ফুটনাঙ্ক | 87.30 K (−185.85 °সে, −302.53 °ফা) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ঘনত্ব | 1.784 গ্রা/লি (০ °সে-এ, ১০১.৩২৫ kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তরলের ঘনত্ব | b.p.: 1.40 g·cm−৩ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ত্রৈধ বিন্দু | 83.8058 কে, 69 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পরম বিন্দু | 150.87 কে, 4.898 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ফিউশনের এনথালপি | 1.18 kJ·mol−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| বাষ্পীভবনের এনথালপি | 6.43 kJ·mol−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপ ধারকত্ব | 5R/2 = 20.786 J·mol−১·K−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
বাষ্প চাপ
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক বৈশিষ্ট্য | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| জারণ অবস্থা | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তড়িৎ-চুম্বকত্ব | no data (পলিং স্কেল) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| আয়নীকরণ বিভব | (আরও) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| সমযোজী ব্যাসার্ধ | 106±10 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ভ্যান ডার ওয়ালস ব্যাসার্ধ | 188 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| বিবিধ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| কেলাসের গঠন | face-centered cubic (fcc) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| শব্দের দ্রুতি | (gas, 27 °C) 323 m·s−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপীয় পরিবাহিতা | 17.72x10-3 W·m−১·K−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| চুম্বকত্ব | diamagnetic[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ক্যাস নিবন্ধন সংখ্যা | 7440–37–1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| সবচেয়ে স্থিতিশীল আইসোটোপ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
পৃথিবীর বায়ুমণ্ডলে প্রাপ্ত প্রায় সমস্ত আর্গন হল তেজষ্ক্রিয়তা-জাত আর্গন-৪০, যা পৃথিবীর ভূত্বকের পটাসিয়াম-৪০ এর ক্ষয় থেকে উৎপন্ন। মহাবিশ্বে আর্গন-৩৬ এখন পর্যন্ত সবচেয়ে সাধারণ আর্গন আইসোটোপ, কারণ এটি সুপারনোভার নাক্ষত্রিক কেন্দ্রীন সংশ্লেষের সময় খুব সহজে উৎপন্ন হয়।
"আর্গন" নামটি গ্রীক শব্দ ἀργόν থেকে এসেছে যার অর্থ "অলস" বা "নিষ্ক্রিয়"। উপাদানটি প্রায় কোনও রাসায়নিক প্রতিক্রিয়া দেখায় না বলেই এই নাম পেয়েছে। আর্গনের সর্ববহিস্থ পারমাণবিক শেল অক্টেট (আটটি ইলেক্ট্রন) দ্বারা পূর্ণ বলে মৌলটি খুবই স্থিতিশীল এবং অন্যান্য মৌলের সাথে বন্ধন প্রতিরোধী। এর ত্রৈধ বিন্দু তাপমাত্রা ৮৩.৮০৫৮ কেলভিন হল ১৯৯০ সালের আন্তর্জাতিক তাপমাত্রা স্কেল নির্ধারণকারী স্থির বিন্দু।
তরল বায়ুর ভগ্নাংশ পাতন দ্বারা আর্গন শিল্পজাতভাবে উৎপাদিত হয়। ওয়েল্ডিং এবং অন্যান্য উচ্চ-তাপমাত্রার শিল্প প্রক্রিয়াগুলিতে প্রতিক্রিয়া রোধক হিসেবে আর্গন ব্যবহৃত হয়। উদাহরণস্বরূপ, গ্রাফাইট তড়িৎ চুল্লীতে গ্রাফাইটের প্রজ্জ্বলন রোধে আর্গনের প্রয়োগ রয়েছে। ফ্লুরোসেন্ট বাতি এবং অন্যান্য গ্যাস-ডিসচার্জ নলে আর্গন ব্যবহৃত হয়। আর্গন একটি স্বতন্ত্র নীলচে-সবুজ গ্যাস লেজার তৈরি করে। ফ্লুরোসেন্ট দীপ্তি স্টার্টারেও আর্গন ব্যবহৃত হয়।
বৈশিষ্ট্য

আর্গনের পানিতে দ্রবণীয়তা প্রায় অক্সিজেনের সমতুল্য এবং নাইট্রোজেনের তুলনায় ২.৫ গুণ বেশি। আর্গন বর্ণহীন, গন্ধহীন, জ্বলন-অযোগ্য, অবিষাক্ত এবং কঠিন, তরল বা গ্যাসীয় অবস্থায় থাকতে পারে।[3] আর্গন বেশিরভাগ পরিস্থিতিতে রাসায়নিকভাবে নিষ্ক্রিয় এবং স্বাভাবিক তাপমাত্রায় জানামতে কোনও স্থিতিশীল যৌগ গঠন করে না।
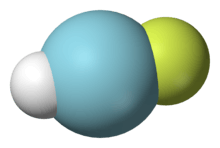
আর্গন একটি নিষ্ক্রিয় গ্যাস হলেও বিভিন্ন চরম পরিস্থিতিতে কিছু যৌগ গঠন করতে পারে। আর্গন ফ্লুরোহাইড্রাইড (HArF) হল ফ্লোরিন, হাইড্রোজেন ও আর্গনের একটি যৌগ যা ১৭ K (−২৫৬.১ °সে; −৪২৯.১ °ফা) তাপমাত্রার নীচে স্থিতিশীল। [4][5] এছাড়াও পানির আণবিক ল্যাটিসে আর্গন পরমাণু আটকা পড়ে জলের সঙ্গে ক্ল্যাথরেট গঠন করতে পারে।[6] আর্গনযুক্ত আয়ন, যেমনঃ ArH+
, এবং উদ্দীপ্ত-দশার যৌগ, যেমন ArF, এর উপস্থিতি প্রদর্শিত হয়েছে। তাত্ত্বিক পর্যালোচনা থেকে আর্গনের আরও কিছু স্থিতিশীল যৌগের পূর্বাভাস পাওয়া গেছে[7] তবে এখনও সংশ্লেষিত করা যায়নি।
ইতিহাস
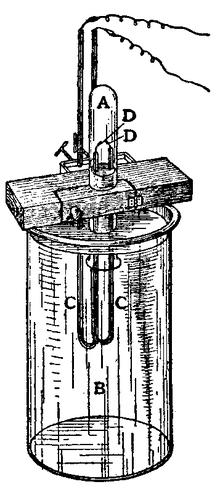
গ্রীক ἀργόν , যার অর্থ "অলস" বা "নিষ্ক্রিয়", শব্দ থেকে আর্গন নামটি আগত। রাসায়নিক নিষ্ক্রিয়তার কারণে এটি এমন নাম পেয়েছে। আর্গনই ছিল প্রথম আবিষ্কৃত নিষ্ক্রিয় গ্যাস।[8][9]
১৭৮৫ সালে হেনরি ক্যাভেন্ডিশ ধারণা করেছিলেন একটি নিষ্ক্রিয় গ্যাস বায়ুর একটি উপাদান হতে পারে। পরে ১৮৯৪ সালে লর্ড রেলি এবং স্যার উইলিয়াম রামজে ইউনিভার্সিটি কলেজ লন্ডনে পরিষ্কার বাতাসের নমুনা থেকে অক্সিজেন, কার্বন ডাই অক্সাইড, জল এবং নাইট্রোজেনকে সরিয়ে সর্বপ্রথম আর্গনকে পৃথক করেছিলেন। [10][11][12] তারা নির্ধারণ করেছিলেন যে রাসায়নিকভাবে উৎপাদিত নাইট্রোজেন, বায়ুমণ্ডলের নাইট্রোজেনের তুলনায় ০.৫% হালকা। পার্থক্যটি সামান্য হলেও বেশ কয়েক মাস ধরে তাদের মনোযোগ লাভের মত যথেষ্ট গুরুত্বপূর্ণ ছিল। তারা উপসংহারে পৌঁছেছিলেন যে নাইট্রোজেনের সাথে মিশ্রিত বাতাসে আরও একটি গ্যাস রয়েছে। [13]
এরও আগে ১৮৮২ সালে এইচ এফ নিউয়াল এবং ডব্লিউ এন হার্টলি স্বতন্ত্র গবেষণার মাধ্যমে আর্গনের মুখোমুখি হয়েছিলেন। তারা বায়ুর নির্গমন বর্ণালীতে নতুন কিছু রেখা লক্ষ্য করেছিলেন যা তৎকালে পরিচিত মৌলগুলোর সাথে সামঞ্জস্যপূ্র্ণ ছিল না।
১৯৫৭ অবধি আর্গনের প্রতীক ছিল "A", তবে এখন এর প্রতীক "Ar"। [14]
উপস্থিতি
আর্গন আয়তনের দিক থেকে পৃথিবীর বায়ুমণ্ডলের ০.৯৩৪% এবং ভরের দিক থেকে ১.২৮৮% অংশ গঠন করে।[15]। বিশুদ্ধ আর্গনের প্রধান উৎস হচ্ছে বায়ু। আর্গনকে বাতাস থেকে বিচ্ছিন্ন করা হয় সাধারণত ক্রায়োজেনিক ভগ্নাংশিক পাতন দ্বারা (একই পদ্ধতিতে বিশুদ্ধ নাইট্রোজেন, অক্সিজেন, নিয়ন, ক্রিপ্টন এবং জেননও উৎপাদন করা হয়)।[16] পৃথিবীর ভূত্বকে এবং সমুদ্রে যথাক্রমে ১.২ ppm এবং ০.৪৫ ppm আর্গন উপস্থিত। [17]
আইসোটোপ
পৃথিবীতে প্রাপ্ত আর্গনের প্রধান আইসোটোপগুলি হল 40
Ar (৯৯.৬%), 36
Ar (০.৩৪%), এবং 38
Ar (০.০৬%)। এছাড়া প্রাকৃতিকভাবে উপস্থিত 40
K এর ইলেকট্রন সংযোজন বা পজিট্রন বিকিরণ জনিত ক্ষয় থেকে 40
Ar (১১.২%) তৈরি হয়। এই বৈশিষ্ট্য এবং অনুপাতগুলো পটাশিয়াম-আর্গন ডেটিং পদ্ধতিতে শিলার বয়স নির্ধারণ করতে সহায়তা করে। [17][18]
পৃথিবীর বায়ুমণ্ডলে 39
Ar পাওয়া যায়, যা মহাজাগতিক রশ্মির ক্রিয়াকলাপ থেকে উদ্ভূত, মূলত 40
Ar এর দ্বি-নিউট্রন বিকিরণ এবং এবং একক-নিউট্রন সংযোজন দ্বারা। ভূ-অভ্যন্তরে 39
K এর নিউট্রন সংযোজন এবং প্রোটন বিকিরণ দ্বারাও 39
Ar তৈরি হয়। এছাড়া ভূ-গর্ভস্থ পারমাণবিক বিস্ফোরণের ফলে 40
Ca এর নিউট্রন সংযোজন এবং আলফা কণা নি:সরণের মাধ্যমে 37
Ar তৈরি হয়, যার অর্ধায়ু ৩৫ দিন। [18]
সৌরজগতের বিভিন্ন স্থানে আর্গনের উপস্থিতির হারে ব্যাপক পার্থক্য দেখা যায়। যেসব স্থানে আর্গনের প্রধান উৎস 40
K এর ক্ষয়, সেখানে প্রধানত 40
Ar পাওয়া যায় (যেমন পৃথিবীতে)। নাক্ষত্রিক কেন্দ্রীন সংশ্লেষে উৎপাদিত আর্গনের মধ্যে আলফা-প্রক্রিয়াজাত 36
Ar নিউক্লাইডের আধিপত্য রয়েছে। সৌর আর্গনে রয়েছে ৮৪.৬% 36
Ar (সৌর বায়ুর পরিমাপ অনুযায়ী)।[19] বাহ্যিক গ্রহগুলোতে তিনটি আইসোটোপের অনুপাত হল 36Ar : 38Ar : 40Ar = ৮৪০০ : ১৬০০ : ১।[20] পৃথিবীর বায়ুমণ্ডলের আদিম 36
Ar এর স্বল্পতা এই অনুপাতের বিপরীতমুখী; বায়ুমণ্ডলে 36
Ar এর পরিমাণ মাত্র ৩১.৫ ppmv (৯৩৪০ ppmv × ০.৩৩৭%), যা পৃথিবীতে এবং আন্তগ্রহ গ্যাসে নিয়নের পরিমাণের (১৮.১৮ ppmv) সঙ্গে তুলনীয়।
মঙ্গল, বুধ এবং টাইটান (শনির বৃহত্তম চাঁদ) এর বায়ুমণ্ডলেও আর্গন রয়েছে (প্রধানত 40
Ar হিসাবে)। এর পরিমাণ ১.৯৩% (মঙ্গল) পর্যন্তও উঠতে পারে। [21]
তেজষ্ক্রিয়তা-জাত 40
Ar এর প্রাধান্যই স্থলজ আর্গনের আদর্শ পারমাণবিক ওজন পরবর্তী উপাদান পটাসিয়ামের চেয়ে বেশি হবার মূল কারণ। এই বৈশিষ্ট্যটি আর্গন আবিষ্কারের সময় যথেষ্ট ধাঁধার উদ্রেক করেছিল, কারণ দিমিত্রি মেন্দেলিয়েভ তার পর্যায় সারণীতে মৌলগুলোকে পারমাণবিক ওজন অনুসারে সাজিয়েছিলেন, তবে আর্গনের নিষ্ক্রিয়তা, প্রতিক্রিয়াশীল ক্ষার ধাতুর আগে তার অবস্থানের সম্ভাবনা প্রদর্শন করছিল। পরবর্তীতে হেনরি মোসলে এই সমস্যাটি সমাধান করে দেখিয়েছিলেন যে পর্যায় সারণীতে প্রকৃতপক্ষে পারমাণবিক সংখ্যার ক্রমে মৌলগুলো সাজানো থাকে (আরও জানার জন্য পর্যায় সারণীর ইতিহাস দেখুন)।
যৌগসমূহ
আর্গনের পরমাণুতে ইলেকট্রনের সম্পূর্ণ অক্টেটটি s এবং p শেলের পূর্ণতা নির্দেশ করে। এই সম্পূর্ণ যোজন শেলটি আর্গনকে খুব স্থিতিশীল করে এবং অন্যান্য মৌলের সাথে সহজে বন্ধন তৈরি প্রতিরোধ করে। ১৯৬২ সালের আগে ধারণা করা হত আর্গন এবং অন্যান্য নিষ্ক্রিয় গ্যাসগুলি রাসায়নিকভাবে জড় এবং যৌগিক পদার্থ গঠনে অক্ষম। তবে পরবর্তী কালে ভারী নিষ্ক্রিয় গ্যাসগুলির যৌগ সংশ্লেষ করা সম্ভব হয়েছে। আর্গনের প্রথম সংশ্লেষিত যোগটি ছিল টাংস্টেন পেন্টাকার্বনিলের সঙ্গে, W(CO)5Ar, যা ১৯৭৫ সালে তৈরি করা হয়েছিল। তবে সে সময় এটি ব্যাপক স্বীকৃতি পায়নি। [22] 2000 সালের আগস্টে হেলসিঙ্কি বিশ্ববিদ্যালয়ের গবেষকরা আর্গন ফ্লুরোহাইড্রাইড (HArF) যৌগটি গঠনে সক্ষম হন। এজন্য তারা কিছুটা সিজিয়াম আয়োডাইড এবং হাইড্রোজেন ফ্লোরাইড সম্পন্ন হিমায়িত আর্গনে অতিবেগুনি রশ্মি প্রয়োগ করেছিলেন।।এই আবিষ্কারটি স্বীকৃতি দেয় যে আর্গন দুর্বলভাবে হলেও যৌগ গঠন করতে পারে। [5][23][24] যোগটি ১৭K (-২৫৬° সেঃ) তাপমাত্রা পর্যন্ত স্থিতিশীল। ২০১০ সালে মেটাস্ট্যাবল ArCF2+
2 ডাইকেশনের পর্যবেক্ষণ করা হয়, যা কার্বনিল ফ্লোরাইড এবং ফসজিনের সঙ্গে যোজন-আইসোইলেকট্রনিক। [25] ক্র্যাব নীহারিকার সুপারনোভা সংশ্লিষ্ট আন্ত:নাক্ষত্রিক মাধ্যমে আর্গন হাইড্রাইড (আর্গোনিয়াম) রূপে আর্গন-৩৬ সনাক্ত করা হয়েছে। এটিই ছিল ছিল পৃথিবীর বাইরে সনাক্তকৃত প্রথম নিষ্ক্রিয় মৌল।[26][27]
কঠিন আর্গন হাইড্রাইড Ar(H2)2 এর স্ফটিক কাঠামো MgZn2 এর লেভ্স দশার অনুরূপ। এটি ৪.৩ থেকে ২২০ গিগাপ্যাসকেল চাপে সংগঠিত হয়, যদিও রামন পরিমাপ থেকে ধারণা পাওয়া যায় যে এর H2 অণুটি ১৭৫ গিগাপ্যাসকেলের অধিক চাপে বিচ্ছিন্ন হয়ে যাওয়ার কথা। [28]
উৎপাদন
শিল্প
ক্রায়োজেনিক বায়ু পৃথকীকরণ ইউনিটে তরল বায়ুর ভগ্নাংশিক পাতন দ্বারা শিল্পক্ষেত্রে আর্গন উৎপাদিত হয়। এই প্রক্রিয়ায় বায়ু থেকে একাধিক গ্যাস পৃথক করা যায়: তরল নাইট্রোজেন, যার স্ফূটনাঙ্ক ৭৭.৩K , আর্গন, যার স্ফূটনাঙ্ক ৮৭.৩ K, এবং তরল অক্সিজেন, যার স্ফূটনাঙ্ক ৯০.২K। প্রতি বছর বিশ্বব্যাপী প্রায় ৭ লাখ টন আর্গন উৎপাদিত হয়। [17][29]
তেজস্ক্রিয় ক্ষয়
40Ar, আর্গনের সর্বাধিক প্রচলিত আইসোটোপের প্রধান উৎস 40K। ১.২৫×১০৯ অর্ধায়ুবিশিষ্ট 40K এর ইলেক্ট্রন সংযোজন বা পজিট্রন বিকিরণ জনিত ক্ষয় থেকে আর্গন পাওয়া যায়। এজন্য ভূত্বকের শিলার বয়স নির্ধারণের জন্য পটাসিয়াম-আর্গন ডেটিং পদ্ধতিতে এটি ব্যবহৃত হয়।
প্রয়োগ

আর্গনের বেশ কয়েকটি পছন্দসই বৈশিষ্ট্য রয়েছে:
- আর্গন একটি রাসায়নিকভাবে নিষ্ক্রিয় গ্যাস।
- নাইট্রোজেনে পর্যাপ্ত নিষ্ক্রিয়তা না পাওয়া গেলে আর্গন সস্তা বিকল্প।
- আর্গনের তাপীয় পরিবাহিতা কম।
- কিছু ক্ষেত্রে আর্গনের তড়িৎ বৈশিষ্ট্যসমূহ (আয়নায়ন এবং / বা নির্গমন বর্ণালী) কাঙ্ক্ষিত।
অন্যান্য নিষ্ক্রিয় গ্যাসগুলোও এসব ক্ষেত্রে সমানভাবে উপযুক্ত হতে পারে, তবে আর্গন সবচেয়ে সস্তা। আর্গন সস্তা, কারণ এটি বাতাসের প্রাকৃতিক উপাদান, এবং ক্রায়োজেনিক বায়ু পৃথকীকরণ প্রক্রিয়ায় বায়ুর বহুলব্যবহৃত শিল্প উপাদান তরল অক্সিজেন এবং তরল নাইট্রোজেনের উপজাত হিসাবে সহজেই পাওয়া যায়। অন্যান্য নিষ্ক্রিয় গ্যাসগুলোও (হিলিয়াম ব্যতীত) এভাবে উৎপাদিত হয়, তবে আর্গনের পরিমাণই সর্বাধিক হয়। আর্গনের বেশিরভাগ প্রয়োগের মূল কারণ হচ্ছে এর নিষ্ক্রিয়তা এবং তুলনামূলক স্বল্পমূল্য।
শিল্পক্ষেত্র
কিছু উচ্চ-তাপমাত্রার শিল্প প্রক্রিয়ায়, যেখানে সাধারণভাবে অ-প্রতিক্রিয়াশীল পদার্থেরও সক্রিয় হয়ে ওঠার সম্ভাবনা থাকে, সেখানে আর্গনের ব্যবহার রয়েছে। উদাহরণস্বরূপ, গ্রাফাইট বৈদ্যুতিক চুল্লিগুলিতে গ্রাফাইটের প্রজ্জ্বলন রোধ করতে আর্গন বায়ুমণ্ডল ব্যবহৃত হয়।
এর মধ্যে কয়েকটি প্রক্রিয়ায় নাইট্রোজেন বা অক্সিজেন গ্যাসের উপস্থিতি ত্রুটি সৃষ্টি করতে পারে। কয়েক ধরনের আর্ক ওয়েল্ডিং যেমন গ্যাস ধাতু আর্ক ওয়েল্ডিং এবং গ্যাস টাংস্টেন আর্ক ওয়েল্ডিংয়ে, এবং টাইটানিয়াম এবং অন্যান্য প্রতিক্রিয়াশীল উপাদানের প্রক্রিয়াকরণে আর্গন ব্যবহৃত হয়। সিলিকন এবং জার্মেনিয়ামের ক্রমবর্ধমান স্ফটিক উৎপাদনে আর্গন বায়ুমণ্ডল প্রয়োগ করা হয়।
পোল্ট্রি শিল্পে পাখিদের দ্রুত শ্বাসরোধে আর্গন ব্যবহৃত হয়, হয় রোগের প্রকোপ এড়াতে ব্যাপক বিনাশের জন্য, অথবা মানবিক বধের উপায় হিসাবে। আর্গন বাতাসের চেয়ে স্বচ্ছ এবং গ্যাসিংয়ের সময় অক্সিজেনকে ভূমির নিকটে স্থানান্তর করে। [30][31] এর অ-প্রতিক্রিয়াশীল প্রকৃতি একে খাদ্য পণ্যের জন্য উপযুক্ত করেছে, এবং যেহেতু এটি মৃত পাখির মধ্যে অক্সিজেন প্রতিস্থাপন করে, তাই আর্গন পোল্ট্রি পণ্যের মেয়াদ বৃদ্ধি করতে পারে। [32]
আর্গন কখনও কখনও আগুন নিবারণের জন্য ব্যবহৃত হয়, বিশেষত যেখানে মূল্যবান সরঞ্জাম সাধারণ জল বা ফোম পদ্ধতির দ্বারা ক্ষতিগ্রস্থ হতে পারে। [33]
বৈজ্ঞানিক গবেষণা
নিউট্রিনো পরীক্ষণ এবং তমোপদার্থ অনুসন্ধানের লক্ষ্যবস্তু হিসাবে তরল আর্গন ব্যবহৃত হয়। তাত্ত্বিকভাবে প্রস্তাবিত দূর্বল মিথষ্ক্রিয়াশীল ভারী কণা বা উইম্পের (WIMP) সঙ্গে আর্গন নিউক্লিয়াসের প্রতিক্রিয়ায় আলোর ঝিলিক তৈরি হবে যা আলোকবিবর্ধক নলে সনাক্তযোগ্য। আর্গন গ্যাসযুক্ত দ্বি-দশা সনাক্তকরণ যন্ত্র উইম্প-আর্গন বিচ্ছুরণকালীন আয়নিত ইলেক্ট্রন সনাক্ত করতে ব্যবহৃত হয়। অন্যান্য তরলীকৃত নিষ্ক্রিয় গ্যাসগুলির মতো আর্গনেরও আলোক বিচ্ছুরণ মাত্রা উচ্চ (প্রায় ৫১ ফোটন/KeV [34]), এটি নিজস্ব বিচ্ছুরিত আলোর সাপেক্ষে স্বচ্ছ এবং বিশোধন করা তুলনামূলক সহজ। আর্গন জেননের তুলনায় সস্তা এবং একটি স্বতন্ত্র বিচ্ছুরণ সময় প্রোফাইল রয়েছে, যা পারমাণবিক ও বৈদ্যুতিক প্রতিঘাত পৃথকীকরণে সাহায্য করে। অন্যদিকে, এর অভ্যন্তরীণ বিটা-রশ্মি পটভূমি 39
Ar দুষণের কারণে বিবর্ধিত (যদি না ভূগর্ভস্থ উৎসের আর্গন ব্যবহার করা হয়)। পৃথিবীর বায়ুমণ্ডলস্থিত বেশিরভাগ আর্গন প্রাকৃতিক 40
K এর দীর্ঘকালীন ইলেকট্রন সংযোজন দ্বারা উৎপন্ন (40
K + e− → 40
Ar + ν)। বায়ুমণ্ডলের 39
Ar এর ক্রিয়াকলাপ 40
Ar এর নকআউট প্রতিক্রিয়া তথা 40
Ar(n,2n)39
Ar এবং অন্যান্য প্রতিক্রিয়া দ্বারা মহাজাগতিকভাবে চলমান। 39
Ar এর অর্ধায়ু মাত্র ২৬৯ বছর। ফলস্বরূপ শিলাস্তর এবং জলের তলদেশে রক্ষিত ভূগর্ভস্থ আর্গনে 39
Ar দূষণ অনেক অল্প।[35] বর্তমানে চলমান যেসব তমোপদার্থ সনাক্ত প্রকল্পে তরল আর্গন ব্যবহার করা হচ্ছে এমন কয়েকটি হল ডার্কসাইড, ওয়ার্প, আরডিএম (ArDM), মাইক্রোক্লিন (microCLEAN) এবং ডিইএপি (DEAP) । ইকারাস (ICARUS) এবং মাইক্রোবুন (MicroBooNE) নিউট্রিনো পরীক্ষাগুলিতে উচ্চ-মাত্রার বিশুদ্ধতাসম্পন্ন তরল আর্গন একটি সময় প্রজেকশন কক্ষে ব্যবহার করে নিউট্রিনো মিথষ্ক্রিয়ার সুক্ষ্ম ত্রিমাত্রিক চিত্র ধারণ করা হয়।
সংরক্ষণ মাধ্যম
মোড়ক উপকরণে অক্সিজেনযুক্ত এবং আর্দ্র বায়ু দূর করে পণ্যের বিপণন মেয়াদ বৃদ্ধির জন্য আর্গনের ব্যবহার রয়েছে (আর্গনের ইউরোপীয় খাদ্য অ্যাডিটিভ কোড ই৯৩৮)। বায়বীয় জারণ, হাইড্রোলাইসিস এবং অন্যান্য রাসায়নিক প্রতিক্রিয়া যা পণ্যমান হ্রাস করে তার প্রতিবন্ধক বা প্রতিরোধ হিসেবে আর্গন ব্যবহৃত হয়। উচ্চ-মাত্রার বিশুদ্ধতাসম্পন্ন রাসায়নিক এবং ঔষধ উপকরণসমূহ অনেক সময় আর্গন গ্যাস সহকারে সীল করে মোড়কজাত করা হয়।
ওয়াইনের তরলপৃষ্ঠ অক্সিজেনের সংস্পর্শে এলে অনুজীবগত বিপাক এবং জারণ ক্রিয়া দ্বারা ওয়াইন নষ্ট হয়ে থেয়ে পারে। তাই ওয়াইন উৎপাদনের ক্ষেত্রে তরলপৃষ্ঠ অক্সিজেন থৈকে পৃথক রাখতে আর্গন ব্যবহার করা হয়।
বার্নিশ, পলিইউরিথেন এবং স্প্রে রং প্রভৃতি এরোসল পণ্যের প্রচালক হিসেবে আর্গন ব্যবহার করা হয়। তাছাড়া মোড়ক বাক্স খোলার পর বায়ু স্থানান্তর করার জন্য আর্গনের ব্যবহার করা হয়। [36]
মার্কিন জাতীয় সংরক্ষণাগারে জাতীয় গুরুত্বপূর্ণ নথিপত্র (যেমন যুক্তরাষ্ট্রের স্বাধীনতার ঘোষণা এবং সংবিধান) অবক্ষয় রোধের জন্য ২০০২ সাল থেকে আর্গন-ভর্তি বাক্সে সংরক্ষণ করা হচ্ছে। গত পাঁচ দশক ধরে ব্যবহৃত হয়ে আসা হিলিয়ামের পরিবর্তে আর্গনের ব্যবহার অগ্রাধিকার পাচ্ছে, কারণ হিলিয়াম বেশিরভাগ পাত্রের আণবিক ছিদ্রের মধ্য দিয়ে অবমুক্ত হয়ে যেতে পারে এবং নিয়মিত এর প্রতিস্থাপন করতে হয়। [37]
পরীক্ষাগার

শ্লেংক লাইন এবং গ্লাভবক্সের নিষ্ক্রিয় গ্যাস হিসেবে আর্গন ব্যবহার করা যায়। যেক্ষেত্রে নাইট্রোজেন গ্যাস অর্থসাশ্রয়ী হলেও বিকারক বা সরঞ্জামের সাথে প্রতিক্রিয়া করতে পারে, সেক্ষেত্রে আর্গন অগ্রাধিকার পায়।
গ্যাস ক্রোমাটোগ্রাফি এবং ইলেক্ট্রোস্প্রে আয়নীকরণ ভর বর্ণালীবিক্ষণে আর্গন বাহক গ্যাস হিসাবে ব্যবহৃত হতে পারে। এটি আইসিপি বর্ণালীবিক্ষণে ব্যবহৃত প্লাজমার জন্য পছন্দনীয় গ্যাস হল আর্গন। স্ক্যানিং ইলেক্ট্রন মাইক্রোস্কোপিতে নমুনার স্পাটার লেপন হিসাবে আর্গনের ব্যবহার প্রচলিত। মাইক্রোইলেক্ট্রনিক্স এবং মাইক্রোফ্যাব্রিকেশনে ওয়েফার পরিষ্কার করা এবং সরু ফিল্মের স্পাটার অবক্ষেপনের জন্যও সাধারণত আর্গন ব্যবহার করা হয়।
চিকিৎসাক্ষেত্র
ক্রায়োসার্জারির বিভিন্ন পদ্ধতি যেমন ক্রায়োব্লেশনে তরল আর্গন ক্ষতিকর টিস্যু ধ্বংসে ব্যবহৃত হয়। এটি "আর্গন-বর্ধিত তঞ্চন" পদ্ধতিতে ব্যবহৃত হয়, যা আর্গন প্লাজমা রশ্মি ভিত্তিক ইলেক্ট্রোসার্জারির একটি প্রকারভেদ। এই পদ্ধতিটিতে গ্যাসীয় এম্বলিজমের ঝুঁকি রয়েছে যা অন্তত একজন রোগীর মৃত্যুর কারণ হয়েছিল। [38]
নীল আর্গন লেজার অস্ত্রোপচারের পর ধমনী পুন:সংযোগে, টিউমার ধ্বংস করতে এবং দৃষ্টিত্রুটি সংশোধনে ব্যবহৃত হয়। [17]
এছাড়াও আর্গনের পরীক্ষামূলক ব্যবহার করা হয়েছে শ্বাস-প্রশ্বাসে সহায়ক এবং চাপ-স্বাভাবিকীকরণ মিশ্রণ আর্গক্স (Argox) এ, নাইট্রোজেনের পরিবর্তে। এর উদ্দেশ্য ছিল রক্তে নাইট্রোজেন দ্রবীভূত হওয়ার সম্ভাবনা বর্জন করা। [39]
আলোকসজ্জা

তাপোজ্জ্বলিত বাতিতে উচ্চ তাপমাত্রায় ফিলামেন্টের জারণ ঠেকানোর জন্য আর্গন গ্যাস দ্বারা বাতির অভ্যন্তর পরিপূর্ণ থাকে। একটি নির্দিষ্ট উপায়ে আলোকে আয়নিত এবং নির্গত করার বৈশিষ্ট্য আছে বলে পরীক্ষামূলক কণা পদার্থবিজ্ঞানে প্লাজমা গোলক এবং ক্যালরিমিতি গবেষণায় আর্গনের ব্যবহার রয়েছে। বিশুদ্ধ আর্গনপূর্ণ গ্যাস-ডিসচার্জ বাতি বেগুনি আলো সৃষ্টি করে, এবং আর্গন ও পারদের সমন্বয়ে নীল আলো তৈরি হয়। নীল এবং সবুজ আর্গন-আয়ন লেজারে আর্গন ব্যবহৃত হয়।
বিবিধ
শক্তি-সাশ্রয়ী জানালায় তাপ নিরোধক হিসেবে আর্গন ব্যবহৃত হয়। [40] কারিগরি স্কুবা ডাইভিংয়ের ক্ষেত্রে শুষ্ক পোশাক স্ফীত করতেও আর্গন ব্যবহৃত হয়, কারণ এটি নিষ্ক্রিয় এবং স্বল্প তাপ পরিবাহী। [41]
ভ্যারিয়েবল স্পেসিফিক ইমপাল্স ম্যাগনেটোপ্লাজমা রকেট (VASIMR) তৈরির সময় এর জ্বালানি হিসেবে আর্গন ব্যবহৃত হয়েছিল। এআইএম-৯ সাইডউইন্ডার এবং আরও কিছু শীতল থার্মাল সীকার ব্যবহারকারী ক্ষেপণাস্ত্রের শীতল তাপমাত্রা বজায় রাখার জন্য সংকুচিত আর্গন প্রয়োগ করা হয়। গ্যাসটি উচ্চচাপে সংরক্ষণ করা হয় । [42]
২৬৯ বছর অর্ধায়ু বিশিষ্ট আর্গন-৩৯ এর বেশ কয়েকটি প্রয়োগ রয়েছে, প্রধানত বরফ স্তর ও ভূগর্ভস্থ পানির ডেটিংয়ের ক্ষেত্রে। তাছাড়া পটাসিয়াম–আর্গন ডেটিং এবং অন্যান্য আর্গন-আর্গন ডেটিং পদ্ধতিতে পলল, রূপান্তরিত শিলা এবং আগ্নেয় শিলার বয়স নির্ণয় করা হয়। [17]
ক্রীড়াবিদরা অক্সিজেনস্বল্পতার অবস্থা অনুকরণের জন্য ডোপিং এজেন্ট হিসাবে আর্গন ব্যবহার করতেন। ২০১৪ সালে, বিশ্ব এন্টি-ডোপিং এজেন্সি (WADA) আর্গন এবং জেননকে নিষিদ্ধ উপাদানের তালিকায় যুক্ত করে, যদিও সে সময়ে এসব পদার্থের অপব্যবহার নির্ণয়ের জন্য কোন নির্ভরযোগ্য পরীক্ষা ছিল না। [43]
নিরাপত্তা
আর্গন বিষাক্ত না হলেও বাতাসের চেয়ে ৩৮% বেশি ঘন, তাই আবদ্ধ এলাকায় শ্বাসরোধক হিসেবে বিপজ্জনক হয়ে উঠতে পারে। এটি বর্ণহীন, গন্ধহীন এবং স্বাদহীন বলে সনাক্ত করা কঠিন। ১৯৯৪ সালে আলাস্কায় নির্মাণাধীন তেল পাইপের একটি আর্গন-পূর্ণ অংশে প্রবেশের পরে একজন ব্যক্তি শ্বাসরুদ্ধ হয়ে মারা গিয়েছিলেন। ঘটনাটি সীমাবদ্ধ স্থানে আর্গন ট্যাঙ্ক নিরাপদ না হওয়ার বিপদগুলি তুলে ধরে এবং গ্যাসটির যথাযথ ব্যবহার ও সংরক্ষণের প্রয়োজনীয়তার উপর জোর দেয়। [44]
আরও দেখুন
- শিল্প গ্যাস
- অক্সিজেন–আর্গন অনুপাত
তথ্যসূত্র
- Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- In older versions of the periodic table, the noble gases were identified as Group VIIIA or as Group 0. See Group (periodic table).
- Material Safety Data Sheet Gaseous Argon, Universal Industrial Gases, Inc. Retrieved 14 October 2013.
- Leonid Khriachtchev & Mika Pettersson (২০০০)। "A stable argon compound": 874–876। doi:10.1038/35022551। PMID 10972285।
- Perkins, S. (২৬ আগস্ট ২০০০)। "HArF! Argon's not so noble after all – researchers make argon fluorohydride"। Science News।
-
Belosludov, V. R.; Subbotin, O. S. (২০০৬)। "Microscopic model of clathrate compounds": 1–7। doi:10.1088/1742-6596/29/1/001

- Cohen, A.; Lundell, J. (২০০৩)। "First compounds with argon–carbon and argon–silicon chemical bonds": 6415। doi:10.1063/1.1613631।
- Hiebert, E. N. (১৯৬৩)। "In Noble-Gas Compounds"। Historical Remarks on the Discovery of Argon: The First Noble Gas। University of Chicago Press। পৃষ্ঠা 3–20।
- Travers, M. W. (১৯২৮)। The Discovery of the Rare Gases। Edward Arnold & Co.। পৃষ্ঠা 1–7।
-
Lord Rayleigh; Ramsay, William (১৮৯৪–১৮৯৫)। "Argon, a New Constituent of the Atmosphere": 265–287। doi:10.1098/rspl.1894.0149

-
Lord Rayleigh; Ramsay, William (১৮৯৫)। "VI. Argon: A New Constituent of the Atmosphere": 187–241। doi:10.1098/rsta.1895.0006

- Ramsay, W. (১৯০৪)। "Nobel Lecture"। The Nobel Foundation।
- "About Argon, the Inert; The New Element Supposedly Found in the Atmosphere"। The New York Times। ৩ মার্চ ১৮৯৫। সংগ্রহের তারিখ ১ ফেব্রুয়ারি ২০০৯।
- Holden, N. E. (১২ মার্চ ২০০৪)। "History of the Origin of the Chemical Elements and Their Discoverers"। National Nuclear Data Center।
- "Argon (Ar)"। Encyclopædia Britannica। সংগ্রহের তারিখ ১৪ জানুয়ারি ২০১৪।
- "Argon, Ar"। Etacude.com। Archived from the original on ৭ অক্টোবর ২০০৮। সংগ্রহের তারিখ ৮ মার্চ ২০০৭।
- Emsley, J. (২০০১)। Nature's Building Blocks। Oxford University Press। পৃষ্ঠা 44–45। আইএসবিএন 978-0-19-960563-7।
- "40Ar/39Ar dating and errors"। ৯ মে ২০০৭ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ৭ মার্চ ২০০৭।
-
Lodders, K. (২০০৮)। "The solar argon abundance": 607–611। arXiv:0710.4523

- Cameron, A. G. W. (১৯৭৩)। "Elemental and isotopic abundances of the volatile elements in the outer planets": 392–400। doi:10.1007/BF00214750।
- Mahaffy, P. R.; Webster, C. R. (২০১৩)। "Abundance and Isotopic Composition of Gases in the Martian Atmosphere from the Curiosity Rover": 263–6। doi:10.1126/science.1237966। PMID 23869014।
- Young, Nigel A. (মার্চ ২০১৩)। "Main group coordination chemistry at low temperatures: A review of matrix isolated Group 12 to Group 18 complexes": 956–1010। doi:10.1016/j.ccr.2012.10.013।
- Kean, Sam (২০১১)। "Chemistry Way, Way Below Zero"। The Disappearing Spoon। Black Bay Books।
- Bartlett, Neil (৮ সেপ্টেম্বর ২০০৩)। "The Noble Gases"।
- Lockyear, JF & Douglas, K (২০১০)। "Generation of the ArCF22+ Dication": 358। doi:10.1021/jz900274p।
-
Barlow, M. J.; Swinyard (২০১৩)। "Detection of a Noble Gas Molecular Ion, 36ArH+, in the Crab Nebula": 1343–1345। arXiv:1312.4843

- Quenqua, Douglas (১৩ ডিসেম্বর ২০১৩)। "Noble Molecules Found in Space"। The New York Times। সংগ্রহের তারিখ ১৩ ডিসেম্বর ২০১৩।
- Kleppe, Annette K.; Amboage, Mónica (২০১৪)। "New high-pressure van der Waals compound Kr(H2)4 discovered in the krypton-hydrogen binary system": 4989। doi:10.1038/srep04989।
- "Periodic Table of Elements: Argon – Ar"। Environmentalchemistry.com। সংগ্রহের তারিখ ১২ সেপ্টেম্বর ২০০৮।
- Fletcher, D. L.। "Slaughter Technology" (PDF)। Symposium: Recent Advances in Poultry Slaughter Technology। ২৪ জুলাই ২০১১ তারিখে মূল (PDF) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১ জানুয়ারি ২০১০।
- Shields, Sara J.; Raj, A. B. M. (২০১০)। "A Critical Review of Electrical Water-Bath Stun Systems for Poultry Slaughter and Recent Developments in Alternative Technologies": 281–299। CiteSeerX 10.1.1.680.5115

- Fraqueza, M. J.; Barreto, A. S. (২০০৯)। "The effect on turkey meat shelf life of modified-atmosphere packaging with an argon mixture": 1991–1998। doi:10.3382/ps.2008-00239

- Su, Joseph Z.; Kim, Andrew K. (২০০১)। "Fire Suppression with Inert Gas Agents": 72–87। doi:10.1106/X21V-YQKU-PMKP-XGTP। আইএসএসএন 1042-3915।
-
Gastler, Dan; Kearns, Ed (২০১২)। "Measurement of scintillation efficiency for nuclear recoils in liquid argon": 065811। arXiv:1004.0373

-
Xu, J. & Calaprice, F. (২৬ এপ্রিল ২০১২)। "A Study of the Residual 39
Ar Content in Argon from Underground Sources": 53–60। arXiv:1204.6011
- Zawalick, Steven Scott "Method for preserving an oxygen sensitive liquid product" মার্কিন পেটেন্ট ৬৬,২৯,৪০২ Issue date: 7 October 2003.
- "Schedule for Renovation of the National Archives Building"। সংগ্রহের তারিখ ৭ জুলাই ২০০৯।
- "Fatal Gas Embolism Caused by Overpressurization during Laparoscopic Use of Argon Enhanced Coagulation"। MDSR। ২৪ জুন ১৯৯৪।
- Pilmanis Andrew A.; Balldin U. I. (২০০৩)। "Staged decompression to 3.5 psi using argon–oxygen and 100% oxygen breathing mixtures": 1243–1250। PMID 14692466।
- "Energy-Efficient Windows"। FineHomebuilding.com। সংগ্রহের তারিখ ১ আগস্ট ২০০৯।
- Nuckols M. L.; Giblo J. (১৫–১৮ সেপ্টেম্বর ২০০৮)। "Thermal Characteristics of Diving Garments When Using Argon as a Suit Inflation Gas"। সংগ্রহের তারিখ ২ মার্চ ২০০৯।
- "Description of Aim-9 Operation"। planken.org। ২২ ডিসেম্বর ২০০৮ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১ ফেব্রুয়ারি ২০০৯।
- "WADA amends Section S.2.1 of 2014 Prohibited List"। ৩১ আগস্ট ২০১৪।
- Alaska FACE Investigation 94AK012 (২৩ জুন ১৯৯৪)। "Welder's Helper Asphyxiated in Argon-Inerted Pipe – Alaska (FACE AK-94-012)"। State of Alaska Department of Public Health। সংগ্রহের তারিখ ২৯ জানুয়ারি ২০১১।
গ্রন্থপঞ্জী
- Brown, T. L.; Bursten, B. E.; LeMay, H. E. (২০০৬)। J. Challice; N. Folchetti, সম্পাদকগণ। Chemistry: The Central Science (10th সংস্করণ)। Pearson Education। পৃষ্ঠা 276 & 289। আইএসবিএন 978-0-13-109686-8।
- Triple point temperature: 83.8058 K – Preston-Thomas, H. (১৯৯০)। "The International Temperature Scale of 1990 (ITS-90)"। Metrologia। 27 (1): 3–10। doi:10.1088/0026-1394/27/1/002। বিবকোড:1990Metro..27....3P।
- Triple point pressure: 69 kPa – Lide, D. R. (২০০৫)। "Properties of the Elements and Inorganic Compounds; Melting, boiling, triple, and critical temperatures of the elements"। CRC Handbook of Chemistry and Physics (86th সংস্করণ)। CRC Press। §4। আইএসবিএন 978-0-8493-0486-6।
বহি:সংযোগ
- দ্য পিরিয়ডিক টেবিল অফ ভিডিওস -এ আর্গন (নটিংহাম বিশ্ববিদ্যালয়)
- ইউএসজিএস পর্যায় সারণি - আর্গন
- ডাইভিংয়ে প্রয়োগ: আর্গন কেন?