রুবিডিয়াম
রুবিডিয়াম (রাসায়নিক সংকেত:Rb পারমাণবিক সংখ্যা ৩৭) একটি মৌলিক পদার্থ। । রুবিডিয়াম একটি ক্ষারধর্মী ধাতু; নরম এবং রুপালী-সাদা বর্ণের। এর [পারমানবিক ভর] 85.4678। অন্যান্য ক্ষারধর্মী ধাতুর মত ধাতব রুবিডিয়াম খুবই সক্রিয়। বাতাসে খুব দ্রুত এটি জারণ হয়।প্রকৃতিতে এর দুইটি আইসোটোপ রয়েছে। এর মধ্যে 85Rb এর পরিমাণ প্রায় ৭২% এবং এটি স্থায়ী। বাকী আইসোটোপটি,87Rb, কিঞ্চিৎ তেজস্ক্রিয় যার অর্ধ-জীবন ৪৯০০ কোটি বছর।
| পরিচয় | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| নাম, প্রতীক | রুবিডিয়াম, Rb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| উচ্চারণ | /r[অসমর্থিত ইনপুট: 'ʉ']ˈbɪdiəm/ roo-BID-ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| উপস্থিতি | grey white | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পর্যায় সারণীতে রুবিডিয়াম | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক সংখ্যা | 37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| আদর্শ পারমাণবিক ভর | 85.4678(3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| মৌলের শ্রেণী | alkali metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| শ্রেণী, পর্যায়, ব্লক | ১, পর্যায় ৫, s-ব্লক | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ইলেকট্রন বিন্যাস | [Kr] 5s1 per shell: 2, 8, 18, 8, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ভৌত বৈশিষ্ট্য | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| দশা | কঠিন | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| গলনাঙ্ক | 312.46 কে (39.31 °সে, 102.76 °ফা) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| স্ফুটনাঙ্ক | 961 K (688 °সে, 1270 °ফা) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ঘনত্ব (ক.তা.-র কাছে) | 1.532 g·cm−৩ (০ °সে-এ, ১০১.৩২৫ kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তরলের ঘনত্ব | m.p.: 1.46 g·cm−৩ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পরম বিন্দু | (extrapolated) 2093 কে, 16 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ফিউশনের এনথালপি | 2.19 kJ·mol−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| বাষ্পীভবনের এনথালপি | 75.77 kJ·mol−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপ ধারকত্ব | 31.060 J·mol−১·K−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
বাষ্প চাপ
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক বৈশিষ্ট্য | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| জারণ অবস্থা | 1 (strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তড়িৎ-চুম্বকত্ব | 0.82 (পলিং স্কেল) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক ব্যাসার্ধ | empirical: 248 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| সমযোজী ব্যাসার্ধ | 220±9 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ভ্যান ডার ওয়ালস ব্যাসার্ধ | 303 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| বিবিধ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| কেলাসের গঠন | body-centered cubic (bcc) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| শব্দের দ্রুতি | পাতলা রডে: 1300 m·s−১ (at 20 °সে) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপীয় পরিবাহিতা | 58.2 W·m−১·K−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| তড়িৎ রোধকত্ব ও পরিবাহিতা | ২০ °সে-এ: 128 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| চুম্বকত্ব | paramagnetic[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ইয়ংয়ের গুণাঙ্ক | 2.4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| আয়তন গুণাঙ্ক | 2.5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (মোজ) কাঠিন্য | 0.3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ব্রিনেল কাঠিন্য | 0.216 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ক্যাস নিবন্ধন সংখ্যা | 7440-17-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| সবচেয়ে স্থিতিশীল আইসোটোপ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
জার্মানির রসায়নবিদ রবার্ট বুনসেন ও গুস্তাভ কির্চকভ ১৮৬১ সালে রুবিডিয়াম আবিস্কার করেন।
রুবিডিয়ামের বিভিন্ন যৌগের রাসায়নিক ও ইলেকট্রনিক প্রচুর ব্যবহার রয়েছে। ধাতব রুবিডিয়ামকে সহজে বাস্পে পরিণতক করা যায়। এই কারণে পরমাণুর লেজার সংক্রান্ত কাজে এটিকে প্রায়শ লক্ষ্যবস্তু করা হয়। কোন জীবিত প্রাণীর জন্য রুবিডিয়ামের কোন প্রয়োজনীয়তার কথা এখনো জানা যায় নি। তবে, উদ্ভিদ ও প্রাণীকোষ যেভাবে পটাশিয়াম আয়নকে ব্যবহার করে রুবিডিয়াম আয়নকেও অনুরুপভাবে ব্যবহার করতে পারে।
আবিষ্কার
১৮৬১ সালে জার্মানীর হাইডেলবার্গ শহরে রবার্ট বুনসেন আর গুস্তাফ কিরচকভ রুবিডিয়াম আবিস্কার করেন।
বৈশিষ্ট্য
রুবিডিয়াম একটি খুব নরম, নমনীয়, রূপালি সাদা ধাতু। অতেজস্ক্রিয় ক্ষারধাতুর মধ্যে রুবিডিয়ামের তড়িৎ-ধনাত্মকতায় দ্বিতীয় এবং ৩৯.৩ ডিগ্রী সেলসিয়াস (১০২.৭ফারেনহাইট) তাপমাত্রায় গলে যায়। অন্যান্য ক্ষার ধাতুর মত রুবিডিয়াম পানির সঙ্গে তীব্রভাবে বিক্রিয়া করে। রুবিডিয়াম পারদের সঙ্গে পারদ-সংকর বা এমালগাম এবং সোনা, লোহা, সিজিয়াম,সোডিয়াম ও পটাশিয়ামের সঙ্গে সংকর-ধাতু সৃষ্টি করে তবে লিথিয়ামের সঙ্গে করে না। যদিও পর্যায়সারণীতে লিথিয়াম ও রুবিডিয়াম একই গ্রুপের অন্তর্ভুক্ত। [2] পানির মধ্যে অপেক্ষাকৃত কম সক্রিয় পটাশিয়াম ও সিজিয়ামের সঙ্গে রুবিডিয়ামের বিক্রিয়ায় এত তাপ উৎপন্ন হয় যে, তা বিক্রিয়ায় মুক্ত হাইপ্রোজেনকে জ্বালাতে পারে। বাতামে স্বত:স্পূর্তভাবে রুবিডিয়াম জ্বলে উঠে বলেও বিভিন্ন রিপোর্টে উল্লেখ করা হয়েছে। [3] রুবিডিয়ামের আয়নায়ন শক্তি খুবই কম, মাত্র 406 kJ/mol.[4] আগুনের শিখা পরীক্ষায় রুবিডিয়াম ও পটাশিয়াম উভয়েই একই রকম বেগুনি রঙের শিখা সৃষ্টি করে ফলে দুই ধাতুতে পৃথকভাবে চিহ্নিত করার জন্য স্পেকট্রোসকোপি পদ্ধতির প্রয়োজন হয়।
ব্যবহার
যৌগসমূহ
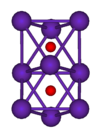
9O
2 cluster
রুবিডিয়ামের যৌগের মধ্যে সম্ভবত রুবিডিয়াম ক্লোরাইডের (RbCl) ব্যবহারই সবচেয়ে বেশি। জৈবরসায়নে কোন সেলে ডিএনএ প্রবৃষ্ট করানো এবং জৈব-নির্দেশক হিসাবে এর ব্যবহার দেখা যায়। জীবিত কোষে পটাশিয়ামকে প্রতিস্থাপিত করার জন্য এটি ব্যবহৃত হয়। অন্যান্য রুবিডিয়াম যৌগের মধ্যে ক্ষয়কারক রুবিডিয়াম হাইড্র অক্সাইড (RbOH) বেশিরভাগ রুবিডিয়াম ভিত্তিক রাসায়নিক প্রক্রিয়ায়; রুবিডিয়াম কার্বনেট (Rb2CO3), অপটিক্যাল কাচে, এবং রুবিডিয়াম কপার সালফেট (Rb2SO4•CuSO4•6H2O. জানা আয়নিক কেলাস সমূহের মধ্যে রুবিডিয়াম সিলভার আয়োডাইডের তাপগ্রহীতা কক্ষ তাপমাত্রায় সর্বোচ্চ। এই বৈশিষ্ট্যের কারণে পাতলা ফিল্ম ব্যাটারি এবং অন্যান্য ক্ষেত্রে এর উপযোগিতা যাচাই করা হচ্ছে। [5][6] রুবিডিয়ামের বেশ কটি অক্সাইড রয়েছে। বাতাসে রেখে দিলে এটি রুবিডয়াম মনোক্সাইডে (Rb2O), Rb6O ও Rb9O2, পরিণত হয়। বাড়তি অক্সিজেন পেলে রুবিডিয়ামের সুপার অক্সাইড RbO2 পাওয়া যায়। হ্যালোজেনের সঙ্গে বিক্রিয়া করে রুবিডিয়াম হ্যালাইড লবণ যথাক্রমে রুবিডিয়াম ফ্লোরাইড, রুবিডিয়াম ক্লোরাইড, রুবিডিয়াম ব্রোমাইড ও রুবিডিয়াম আয়োডাইড সৃষ্টি করে।
প্রাপ্যতা
ভূ-ত্বকে প্রাপ্যতার হিসাবে রুবিডিয়াম ২৩তম। প্রকৃতিতে এর প্রাচুর্য দস্তার মত, এমনকী তামার চেয়ে বেশি। [7]
রাসায়নিক বিক্রিয়া
উৎস
- ব্রিটানিকা বিশ্বকোষ (Encyclopedia Britannica)
তথ্যসূত্র
- Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (১৯৮৫)। "Vergleichende Übersicht über die Gruppe der Alkalimetalle"। Lehrbuch der Anorganischen Chemie (German ভাষায়) (91–100 সংস্করণ)। Walter de Gruyter। পৃষ্ঠা 953–955। আইএসবিএন 3-11-007511-3।
- Ohly, Julius (১৯১০)। "Rubidium"। Analysis, detection and commercial value of the rare metals। Mining Science Pub. Co.।
- Moore, John W; Stanitski, Conrad L; Jurs, Peter C (২০০৯)। Principles of Chemistry: The Molecular Science। পৃষ্ঠা 259। আইএসবিএন 978-0-495-39079-4।
- Lesley smart, Moore, Elaine (১৯৯৫)। "RbAg4I5"। Solid state chemistry: an introduction। CRC Press। পৃষ্ঠা 176–177। আইএসবিএন 978-0-7487-4068-0।
- J. N. Bradley Greene, P. D. (১৯৬৭)। "Relationship of structure and ionic mobility in solid MAg4I5"। Trans. Faraday Soc.। 63: 2516। doi:10.1039/TF9676302516।
- Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (২০০৩)। "Mineral Commodity Profile: Rubidium" (PDF)। United States Geological Survey। সংগ্রহের তারিখ ২০১০-১২-০৪।