দ্রাব্যতা
দ্রাব্যতা পদার্থের একটি ভৌত ধর্ম। কোন নির্দিষ্ট তাপমাত্রায় নির্দিষ্ট পরিমাণ দ্রাবককে সম্পৃক্ত দ্রবণে পরিণত করতে যে পরিমান দ্রব দ্রবীভূত করতে হয় তাকেই ঐ তাপমাত্রায় ঐ দ্রবের দ্রাব্যতা বলে। কোন পদার্থের দ্রাব্যতা প্রকৃতপক্ষে ব্যবহৃত দ্রাবক, তাপমাত্রা ও চাপের উপর নির্ভর করে। তাপমাত্রার মত চাপও দ্রবণকে প্রভাবিত করে, সেটা তরল হোক বা বায়বীয়ই হোক। তাই দ্রাব্যতার সংজ্ঞা দেওয়ার সময় একটি নির্দিষ্ট তাপমাত্রা ও চাপ উল্লেখ করা হয়। দ্রাব্যতা প্রকাশ করা হয় ঘনমাত্রা প্রকাশের বিভিন্ন একক (মোলারিটি, মোলালিটি, নরমালিটি ইত্যাদি) দ্বারা। কারণ দ্রাব্যতা মূলত কোন দ্রবণে দ্রবের সর্বোচ্চ ঘনমাত্রাকেই প্রকাশ করে । দ্রাব্যতা একটি আনুপাতিক রাশি । এর কোন একক নেই। যেমনঃ ৩৫ ডিগ্রি তাপমাত্রায় KNO3 এর দ্রাব্যতা হল 60 তাহলে বোঝা যাবে যে ঐ তাপমাত্রায় 100g পানিতে সর্বাধিক 60g KNO3 দ্রবীভূত হয়ে দ্রবণ উৎপন্ন করবে ।
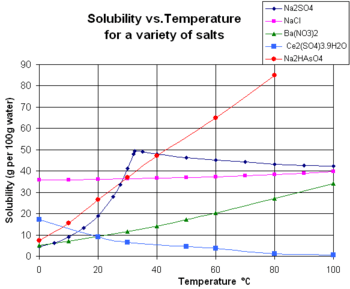
দ্রাব্যতার উপর চাপের প্রভাব
তরল দ্রাবকে গ্যাসীয় দ্রব দ্রবীভূত হওয়ার ক্ষেত্রে চাপের প্রভাব পরিলক্ষিত হয় । বিজ্ঞানী হেনরীর সুত্রানুসারে স্থির তাপমাত্রায় নির্দিষ্ট আয়তনের কোন তরল পদার্থে কোন গ্যাসের দ্রাব্যতা এর উপর প্রযুক্ত চাপের সমানুপাতিক । অর্থাৎ চাপ যত গুন বৃদ্ধি /হ্রাস করা হবে ঐ দ্রাবকে ঐ দ্রবের দ্রাব্যতা ঠিক তত গুনই বৃদ্ধি/হ্রাস পাবে। তবে এ ক্ষেত্রে গ্যাস ও তরল এর মধ্যে কোন রাসায়নিক বিক্রিয়া ঘটেনা ।উদাহরণ স্বরপ তরল পানীয় বা সোডা ওয়াটারের বোতলেে উচ্চ চাপে co2 গ্যাস দ্রবীভূত থাকে। বোতলের মুখ খোলার সাথে সাথে বোতলের ভিতরের চাপ কমে যায় এবং অতিরিক্ত co2 গ্যাস বুদবুদ আাকারে বেরিয়ে আসে। চাপ হ্রাসের সাথে সাথে co2 এর দ্রাব্যতার হ্রাস ঘটে তাই এমনটি হয়।
দ্রাব্যতা গুণফল
নির্দিষ্ট তাপমাত্রায় কোনো স্বল্প দ্রবণীয় লবণের দ্রবণে তার উপাদান আয়নসমুহের ঘাত সহ ঘনমাত্রার সর্বোচ্চ গুণফলককে লবণটির দ্রাব্যতা গুণফল বলে।এটি একটি ধ্রুবক।এর কোন একক নেই একে Ksp দ্বারা প্রকাশ করা হয়।