হ্যালোজেন
হ্যালোজেন বলতে পর্যায় সারণীর সপ্তম শ্রেণীভুক্ত সমধর্মী এক গুচ্ছ মৌলিক পদার্থকে বোঝায়। এগুলো আধুনিক পর্যায় সারণীতে ১৭শ শ্রেণীর অন্তর্ভুক্ত। যে পাঁচটি মৌলিক পদার্থ হ্যালোজেন হিসেবে চিহ্নিত সেগুলো হলো ফ্লোরিন (F), ক্লোরিন (Cl), ব্রোমিন (Br), আয়োডিন (I), এবং অ্যাস্টাটিন (At)। কৃত্রিম উপায়ে তৈরী ১১৭ পারমাণবিক সংখ্যা বিশিষ্ট মৌল ইউনুনসেপ্টিয়ামে হ্যালোজেন শ্রেণীর মৌলসমূহের বৈশিষ্ট বিদ্যমান রয়েছে।ফ্লোরিনকে বলা হয় সুপার হ্যালোজেন এবং অ্যাস্টাটিন ম্যান মেড হ্যালোজেন নামে পরিচিত।
| শ্রেণী | ১৭ | |
|---|---|---|
| পর্যায় | ২ |  ৯ F |
| ৩ |  ১৭ Cl | |
| ৪ |  ৩৫ Br | |
| ৫ |  ৫৩ I | |
| ৬ | ৮৫ At |
ইতিহাস এবং শব্দতত্ত্ব
হ্যালোজেন কথাটির অর্থ সামুদ্রিক লবণ উৎপাদক।সমুদ্রের জলে উপস্থিত সমস্ত লবণই বিভিন্ন ধাতব ফ্লুরাইড,ক্লোরাইড, ব্রোমাইড বা আয়োডাইড যৌগ,তাই এদের এমন নামকরণ করা হয়েছে।অ্যাস্টাটিন মৌলটি কৃত্রিমভাবে প্রস্তুত করা হয়েছে,এই কারণে একে ম্যান মেড হ্যালোজেন বলা হয়। এদেরকে X দ্বারা প্রকাশ করা হয়।
শ্রেণীর সাধারণ বৈশিষ্টসমূহ
পর্যায় সারণীর অন্যান্য শ্রেণীগুলোর মত হ্যালোজেনগুলোরও কিছু সাধারণ বৈশিষ্ট রয়েছে। সাধারণত পরমাণুর ইলেক্ট্রন বিন্যাস এর উপর ভিত্তি করে মৌলগুলোকে আলাদা আলাদা শ্রেণীতে বিভক্ত করা হয়েছে। এই শ্রেণীর সাধারণ বৈশিষ্টগুলো নিচে উল্লেখ করা হল:
| Z | মৌল | ইলেকট্রনের শক্তিস্তর |
|---|---|---|
| 9 | ফ্লোরিন | 2, 7 |
| 17 | ক্লোরিন | 2, 8, 7 |
| 35 | ব্রোমিন | 2, 8, 18, 7 |
| 53 | আয়োডিন | 2, 8, 18, 18, 7 |
| 85 | অ্যাস্টাটিন | 2, 8, 18, 32, 18, 7 |
| হ্যালোজেন | Standard Atomic Weight (u) | গলনাঙ্ক (K) | স্ফুটনাঙ্ক (K) | ঋণাত্মকতা (Pauling) |
| ফ্লোরিন | 18.998 | 53.53 | 85.03 | 3.98 |
| ক্লোরিন | 35.453 | 171.60 | 239.11 | 3.16 |
| ব্রোমিন | 79.904 | 265.80 | 332.00 | 2.96 |
| আয়োডিন | 126.904 | 386.85 | 457.40 | 2.66 |
| অ্যাস্টাটিন | (210) | 575.00 | 610 (?) | 2.20 |
দ্বিপরমাণুক হ্যালোজেন মৌল
| হ্যালোজেন | অণু | কাঠামো | অনুকৃতি | d(X−X) / pm (বায়বীয় অবস্থা) | d(X−X) / pm (কঠিন অবস্থা) |
|---|---|---|---|---|---|
 | |||||
 | |||||
রাসায়নিক বৈশিষ্টসমূহ
মৌলসমূহের রাসায়নিক ধর্ম এর পরমাণুর বহিঃস্তরের ইলেক্ট্রন কাঠামো দ্বারাই নির্ণীত ও নিয়ন্ত্রিত হয়।[1] মৌলের আণবিক সংখ্যা যত বেশী হয় হ্যালোজেনের সক্রিয়তা হ্রাস পায় এবং গলনাঙ্ক বৃদ্ধি পায়।
তড়িৎ ঋণাত্বকতা
পরমাণুর আকার যত ছোট হয় তড়িৎ ঋণাত্বকতার মান তত বশী হয়। ফ্লোরিন থেকে আয়োডিনের দিকে পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে পরমাণুর আকার বৃদ্ধি পায় বলে তড়িৎ ঋণাত্বকতার মান কমেই হ্রাস পায়। হ্যালোজেনসমূহ তীব্র তড়িৎ ঋণাত্বক। এদের তড়িৎ ঋণাত্বকতার ক্রম হলো F > Cl > Br> I > At । হ্যালোজেনসমূহের তড়িৎঋণাত্নকতার মান হচ্ছে ফ্লোরিন=৪, ক্লোরিন=৩, ব্রোমিন=২।৭ এবং আয়োডিন=২।২
যোজ্যতা
পরমাণুর সর্ববহিস্থ স্তরে সাতটি ইলেকট্রন থাকায় নিকষ্টস্থ নিষ্ক্রিয় গ্যাসের ন্যায় অষ্টক পূর্ণতার জন্যে একটি ইলেকট্রন প্রয়োজন বলে সব হ্যালোজেনের সাধারণ যোজনী এক।
জারণক্ষমতা
হ্যালোজেনসমূহ উত্তম জারক। কারণ, ইলেকট্রনের প্রতি এদের তীব্র আকর্ষণ রয়েছে। তাই রাসায়নিক বিক্রিয়াকালে এরা সহজে এবং দ্রুত ইলেকট্রন গ্রহণ করে।
রাসায়নিক বিক্রিয়া
১.জলের সঙ্গে বিক্রিয়া:জলের সঙ্গে বিক্রিয়া করে হ্যালোজেনগুলি একটি শক্তিশালী অ্যাসিড এবং একটি দুর্বল অ্যাসিড উৎপন্ন করে। দুর্বল অ্যাসিডটি দ্রূত বিয়োজিত হয়ে জায়মান অক্সিজেন উৎপন্ন করে,যা হ্যালোজেনগুলির জারণ ধর্মের জন্য দায়ী। X2(aq) + H2O(l) → HX(aq) + HOX(aq) HOX(aq)→HX(aq)+[O](জায়মান অক্সিজেন) এই জায়মান অক্সিজেনই ক্লোরিনের বিরঞ্জন ধর্মের কারণ। রঙিন পদার্থ+[O]→বিরঞ্জিত পদার্থ
২.ধাতুর সঙ্গে বিক্রিয়া:ধাতুকে জারিত করে এরা ধাতব হ্যালাইড গঠন করে। Mg(s)+Br2(l)→MgBr2(s) 2Fe(s)+3Cl2(g)→2FeCl3(s)
৩.অধাতুর সঙ্গে বিক্রিয়া:নাইট্রোজেন,ফসফরাস,সিলিকন প্রভৃতি অধাতুর সঙ্গে বিক্রিয়া করে অধাতব হ্যালাইড উৎপাদন করে। N2(g)+3Cl2(g)→2NCl3(g) P4(s)+10Cl2(g)→4PCl5(g)
৪.হাইড্রোজেনের সঙ্গে বিক্রিয়া:হাইড্রোজেনের সঙ্গে বিক্রিয়া করে হ্যালোজেনসমূহ হাইড্রোজেন হ্যালাইড প্রদান করে।সাধারণ তাপমাত্রায় HF তরল কিন্তু বাকি হাইড্রোজেন হ্যালাইডগুলি গ্যাস,কারণ HF আন্তরাণবিক হাইড্রোজেন বন্ধন গঠন করলেও বাকিরা করে না।এদের স্টেবলিটির ক্রম:HF>HCl>HBr>HI H2(g)+X2(g)→2HX(g/l)
৫.অক্সিজেনের সঙ্গে বিক্রিয়া:হ্যালোজেনগুলি অক্সিজেনের সহিত বিক্রিয়া করে যে সমস্ত দ্বি-যৌগ গঠন করে তাদের বেশিরভাগই অস্থিতিশীল।ফ্লোরিন অক্সিজেনের সঙ্গে দুটি যৌগ গঠন করে:O2F2 এবং OF2।ক্লোরিন সবচেয়ে বেশি সংখ্যক এবং আয়োডিন সবচেয়ে কম সংখ্যক অক্সাইড গঠন করে থাকে।এগুলি সরাসরি অক্সিজেনের সঙ্গে হ্যালোজেনের বিক্রিয়া দ্বারা প্রস্তুত করা যায় না।যেমন- 2F2+2NaOH(2%)→2NaF+OF2+H2O
৬.হ্যালোজেনসমূহের পারস্পরিক বিক্রিয়া:হ্যালোজেনগুলি নিজেদের মধ্যে বিক্রিয়া করে আন্তঃহ্যালোজেন যৌগ গঠন করে।যেমন-Cl2(g)+F2(g)+Heat→2ClF(g)
উৎপাদন
প্রয়োগ
জৈব ভূমিকা
বিষাক্ততা
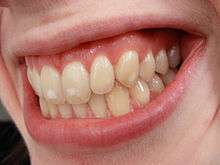
হ্যালোজেন মৌলগুলির ক্ষেত্রে আণবিক ভর বৃদ্ধির সাথে সাথে বিষাক্ততা ক্রমশঃ হ্রাস পায়। ফ্লোরিন গ্যাস অত্যন্ত বিষাক্ত হয়; কয়েক মিনিটের জন্য 0.1% ঘনত্বের ফ্লোরিন গ্যাস শ্বাসকার্যের মাধ্যমে গ্রহণ করাও প্রাণঘাতী। ডেন্টাল ফ্লুরোসিস,হাড়ের ফ্লুরোসিস প্রভৃতি রোগ সৃষ্টি করে এই গ্যাস। হাইড্রোফ্লোরিক অ্যাসিডও বিষাক্ত, ত্বকের ভেতর প্রবেশ করে এবং অত্যন্ত বেদনাদায়ক পোড়া সৃষ্টি করে। উপরন্তু, ফ্লোরাইড আয়ন (F-) বিষাক্ত, কিন্তু বিশুদ্ধ ফ্লোরিনের মতো বিষাক্ত নয়। ফ্লোরাইড 5 থেকে 10 গ্রাম পরিমাণে প্রাণঘাতী হতে পারে।
ক্লোরিন গ্যাস অত্যন্ত বিষাক্ত। প্রতি মিলিয়ন অংশে এক ঘনত্বের ক্লোরিন প্রশ্বাসের সঙ্গে গ্রহণ করলে দ্রুত বিষাক্ত প্রতিক্রিয়া সৃষ্টি করতে পারে। মিলিয়ন প্রতি 50 অংশ ঘনত্বের ক্লোরিন বাষ্পযুক্ত শ্বাস অত্যন্ত বিপজ্জনক। কয়েক মিনিটের জন্য প্রতি মিলিয়নে 500 অংশ ঘনত্বের ক্লোরিন যুক্ত শ্বাস প্রাণঘাতী হয়। হাইড্রোক্লোরিক অ্যাসিড একটি বিপজ্জনক রাসায়নিক।
ব্রোমিন কিছুটা বিষাক্ত, তবে ফ্লুরিন এবং ক্লোরিনের তুলনায় কম বিষাক্ত। 100 মিলিগ্রাম ব্রোমিন প্রাণঘাতী। 30 গ্রাম ব্রোমিনও প্রাণঘাতী হয়।
আয়োডিনটি কিছুটা বিষাক্ত, ফুসফুসের সমস্যা সৃষ্টি করে এবং চোখের জীবাণুকে প্রতি ঘন মিটারে 1 মিলিগ্রাম সুরক্ষা সীমাবদ্ধ করে। মৌখিকভাবে গ্রহণ করা হলে, 3 গ্রাম আয়োডিন প্রাণঘাতী হতে পারে। আয়োডাইড আয়ন বেশিরভাগ ক্ষেত্রেই অবিষাক্ত হয়, কিন্তু বড় পরিমাণে ইহা মারাত্মক হতে পারে।
অ্যাস্টাটিন খুব তেজস্ক্রিয়,তাই অত্যন্ত বিপজ্জনক।[2]
আরও দেখুন
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
| Halogens | Atomic numbers in red are gases | Atomic numbers in green are liquids | Atomic numbers in black are solids |
|---|---|---|---|
| Solid borders indicate primordial elements (older than the Earth) | Dashed borders indicate radioactive natural elements | Dotted borders indicate radioactive synthetic elements | No borders indicates undiscovered elements |