பொட்டாசியம் நைத்திரேட்டு
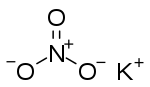
பொட்டாசியம் நைத்திரேட்டு KNO3 என்னும் வாய்பாட்டினால் குறிக்கப்படும் ஒரு வேதியியல் சேர்வை ஆகும். இது பொட்டாசியம் அயன்களையும் K+ நைத்திரேட்டு அயன்களையும் NO3− கொண்ட ஒரு அயனி உப்பு. இது வெடியுப்பு என்னும் கனிம வடிவில் இயற்கையில் கிடைக்கிறது. இது இயற்கையில் திண்ம நிலையில் உள்ள நைதரசன் சேர்வைகளில் ஒன்று.
 | |
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
பொட்டாசியம் நைத்திரேட்டு | |
| வேறு பெயர்கள்
வெடியுப்பு | |
| இனங்காட்டிகள் | |
| 7757-79-1 | |
| ChemSpider | 22843 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| KEGG | D02051 |
| பப்கெம் | 24434 |
| வே.ந.வி.ப எண் | TT3700000 |
SMILES
| |
| UNII | RU45X2JN0Z |
| UN number | 1486 |
| பண்புகள் | |
| KNO3 | |
| வாய்ப்பாட்டு எடை | 101.1032 கி/மோல் |
| தோற்றம் | வெண்ணிறத் திண்மம் |
| மணம் | மணமற்றது |
| அடர்த்தி | 2.109 கி/சமீ3 (16 °ச) |
| உருகுநிலை | |
| கொதிநிலை | 400 °ச decomp. |
| 133 கி/லீ (0 °ச) 360 கி/லீ (25 °ச) 2470 கி/லீ (100 °ச) | |
| கரைதிறன் | எத்னாலில் ஓரளவு கரையும் கிளைக்கோலில் கரையும், அமோனியா |
| கட்டமைப்பு | |
| படிக அமைப்பு | Orthorhombic, Aragonite |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | ஒட்சியேற்றி, விழுங்கினாலோ, மூக்குவழி உள்ளிழுத்தாலோ அல்லது தோல்வழியாக உறிஞ்சப்படாலோ தீங்கானது.. தோல், கன் ஆகிய பகுதிகளில் எரிவு ஏற்படும்.. |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 0184 |
| ஈயூ வகைப்பாடு | Oxidant (O) |
| R-சொற்றொடர்கள் | R8 R22 R36 R37 R38 |
| S-சொற்றொடர்கள் | S7 S16 S17 S26 S36 S41 |
| தீப்பற்றும் வெப்பநிலை | எரியாது |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose) |
3750 மிகி/கிகி |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | பொட்டாசியம் நைத்திரேட்டு |
| ஏனைய நேர் மின்அயனிகள் | லித்தியம் நைத்திரேட்டு சோடியம் நைத்திரேட்டு ருபிடியம் நைத்திரேட்டு கேசியம் நைத்திரேட்டு |
| தொடர்புடைய சேர்மங்கள் | பொட்டாசியம் சல்பேட்டு பொட்டாசியம் குளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
பொட்டாசியம் நைத்திரேட்டு ஒரு செயற்கை உரமாகப் பெருமளவில் பரவலாகப் பயன்படுகின்றது. இதைவிட ராக்கெட்டுகளில் எரிபொருளாகவும், வாணவெடி உற்பத்தியிலும் இது பயன்படுகிறது. வெடிமருந்திலும் இது ஒரு சேர்பொருளாக உள்ளது. உணவில் சேர்ப்பானாக பயன்படும்போது, ஐரோப்பிய ஒன்றியத்தில் இது E252 என்னும் எண்ணால் குறிப்பிடப்படுகின்றது.
உற்பத்தி
அமோனியம் நைத்திரேட்டு, பொட்டாசியம் ஐதரொட்சைட்டு ஆகியவற்றைச் சேர்ப்பதன் மூலம் பொட்டாசியம் நைத்திரேட்டு செய்யப்படுகிறது.
- NH4NO3 (aq) + KOH (aq) → NH3 (g) + KNO3 (aq) + H2O (l)
அமோனியம் நைத்திரேட்டையும், பொட்டாசியம் குளோரைடையும் சேர்த்தும் பொட்டாசியம் நைத்திரேட்டை உற்பத்தி செய்யலாம். இம்முறையில் அமோனியா துணை விளைவாகக் கிடைக்காது.
- NH4NO3 (aq) + KCl (aq) → NH4Cl (aq) + KNO3 (aq)
நைத்திரிக் அமிலத்துடன் பொட்டாசியம் ஐதரொட்சைட்டைச் சேர்த்தும் பொட்டாசியம் நைத்திரேட்டைப் பெற முடியும். இது பெருமளவில் வெப்பத்தை வெளிவிடும் ஒரு வெப்பம் உமிழ் தாக்கம் ஆகும்.
- KOH (aq) + HNO3 → KNO3 (aq) + H2O (l)
இயல்புகள்
அறை வெப்பநிலையில், பொட்டாசியம் நைத்திரேட்டு ஒரு நேர்ச்சாய்சதுரப் பளிங்கு அமைப்புக் கொண்டது. இது 129 °ச வெப்பநிலையில் முக்கோணப் பளிங்கு அமைப்பாக மாறுகிறது. 560 °ச வெப்பநிலைக்குச் சூடேற்றும்போது இது பொட்டாசியம் நைத்திரைட்டு, ஒட்சிசன் ஆகியவையாகப் பிரிவடைகிறது.
- 2 KNO3 → 2 KNO2 + O2
பொட்டாசியம் நைத்திரேட்டு நீரில் ஓரளவுக்கே கரையும். வெப்பநிலை கூடும்போது கரைதிறனும் கூடும். இதன் நீர்க் கரைசல் ஏறத்தாழ நடுநிலையானது. வணிகத் தூளின் 10% கரைசல் 14 °ச வெப்பநிலையில் 6.2 pH அளவைக் காட்டுகிறது. இது பெரிய நீருறிஞ்சி அல்ல. 80% சாரீரப்பதனில், 50 நாட்களில் 0.03% நீரையே உறிஞ்சுகிறது. நச்சுத்தன்மை இல்லாத இச்சேர்வை அல்ககோலில் கரைவதில்லை. தாழ்த்திகளுடன் வெடிப்புடன் வினை புரிகிறது (தாக்கமுறுகிறது). ஆனால், இது தானாக வெடிக்கக்கூடியது அல்ல.[2]
பயன்பாடு
பொட்டாசியம் நைத்திரேட்டு பெரும்பாலும் செயற்கை உரங்களில் பயன்படுகிறது. இது பயிர்களுக்குத் தேவையான பேரூட்டப் பொருள்களான நைதரசன், பொட்டாசியம் ஆகியவற்றை வழங்குகிறது. தனியாகப் பயன்படுத்தும்போது இது 13-0-44 NPK தரநிலை கொண்டது. வெடிமருந்திலும், மரக்கரி, கந்தகம் என்பவற்றுடன் மூன்றாவது சேர்பொருளாகப் பொட்டாசியம் நைத்திரேட்டு பயன்படுகிறது. இதில் இச்சேர்வை ஒரு ஒட்சியேற்றியாகத் தொழிற்படுகிறது.
உணவுப்பாதுகாப்பு வழிமுறைகளிலும், மத்தியகாலத்தில் இருந்தே உப்பிட்ட இறைச்சிப் பொருட்களில் ஒரு சேர்பொருளாகப் பொட்டாசியம் நைத்திரேட்டுப் பயன்பட்டு வந்தது.[3] எனினும் இதன் விளைவு மாறுபடுகின்ற தன்மை உள்ளதாகக் காணப்படுவதால் தற்காலத்தில் இதற்குப் பதிலாக வேறு நைத்திரேட்டு, நைத்திரைட்டுச் சேர்வைகள் பயன்படுகின்றன. எனினும் வெடியுப்பு இப்போதும் சில உணவுப்பாதுகாப்பு முறைகளில் பயன்பட்டு வருகிறது. தற்காலத்தில், சமையல் சார்ந்த பயன்பாடுகளில் வெடியுப்புக்குப் பதிலாக, சோடியம் நைத்திரேட்டும், சோடியம் நைத்திரைட்டும் பயன்படுகின்றன. இச்சேர்வைகள் நுண்ணுயிர்த் தொற்றுக்களைத் தடுப்பதில் கூடுதலான நம்பத்தகுந்த விளைவுகளைத் தரக்கூடியவை. இம்மூன்று சேர்வைகளுமே பதப்படுத்திய தொத்திறைச்சிக்கும் (sausage), உப்பிட்டுப் பதப்படுத்திய மாட்டிறைச்சிக்கும் அவற்றின் இளஞ்சிவப்பு நிறத்தைக் கொடுக்கின்றன.
பொட்டாசியம் நைத்திரேட்டு ஒரு செயற்றிறன் மிக்க ஒட்சியேற்றி. இதில் பொட்டாசியம் இருப்பதனால் எரியும்போது இளம் ஊதாநிறச் சுவாலையைக் கொடுக்கிறது. இதனால், தொழிமுறைசாராத எவுகணை உந்திகளிலும், புகைக் குண்டுகள் போன்ற வாணவெடிகளிலும் இது பயன்படுகிறது.[4] புகையிலை சீராக எரிவதற்காக வெண்சுருட்டுக்களிலும் இதைச் சேர்க்கின்றனர்.[5] விசிறல் வகைத் தீத்தடுப்புத் தொகுதிகளில் பொட்டாசியம் நைத்திரேட்டு முக்கியமான திண்மத் துகள் கூறுகளில் ஒன்றாக உள்ளது. இது எரிந்து, தீச்சுவாலையில் உள்ள முடிவுறா மூலக்கூறுகளுடன் சேரும்போது பொட்டாசியம் காபனேட்டை உருவாக்குகிறது.
மர அடிக்கட்டைகளின் இயற்கைச் சிதைவை விரைவாக்குவதால், மர அடிக்கட்டை அகற்றிகளில் பொட்டாசியம் நைத்திரேட்டு ஒரு முக்கிய கூறாக உள்ளது. வழமையாக இது 98% வரை இருக்கும்.[6] உலோகங்களின் வெப்பப்பதனிடலிலும் கழுவுவதற்கான கரைப்பானாக இது பயன்படுகின்றது. இதன் ஒட்சியேற்றும் தன்மை, நீரில் கரையும் தன்மை, விலை குறைவாக இருத்தல் என்பவற்றால், இது ஒரு குறுகியகாலத் துருத் தணிப்பானாகப் பயன்படுத்த ஏற்ற பொருள் ஆகவும் உள்ளது.
மருந்தியல்
பற்கூச்சத்தைக் குறைப்பதற்கான சில பற்பசைகளில் பொட்டாசியம் நைத்திரேட்டு சேர்க்கப்படுகிறது.[7] அண்மைக் காலங்களில் பொட்டாசியம் நைத்திரேட்டின் இந்தப் பயன்பாடு அதிகரித்துள்ளதுடன், பற்கூச்சத்துக்கு இது ஒரு பயனுள்ள சிகிச்சையாக அமையலாம் எனவும் சொல்லப்படுகிறது.[8][9] பற்பசைகளில் காணப்படும் பொட்டாசியம் நைத்திரேட்டு, சில மூச்சுத்தடை நோயாளிகளில் நோயின் அறிகுறிகளைக் குறைப்பதாகவும் கருத்து உள்ளது. இது பல நூற்றாண்டுகளுக்கு முன்னரே மூச்சுத்தடை நோய்க்கும், கீல்வாதத்துக்கும் மருத்துவம் செய்வதில் பயன்பட்டுள்ளது.
இது உயர் இரத்த அழுத்தத்தை எதிர்க்கக்கூடியது. இதனால், உயர் இரத்த அழுத்தத்தைக் குறைக்கும் மருந்துகளில் முன்னர் இது பயன்பட்டது. கிளிசரில் முந்நைத்திரேட்டு, அமைல் நைத்திரைட்டு போன்ற சில நைத்திரேட்டுக்களும், நைத்திரைட்டுக்களும் இப்போதும் இதயவலியைக் குறைப்பதற்கான மருந்துகளில் பயன்படுகின்றன.
பொட்டாசியம் நைத்திரேட்டு ஆண்மைக் குறைவைத் தூண்டுவதாக முன்னர் கருதப்பட்டது. படைத்துறை நிலைகளில் பாலுணர்வைக் குறைப்பதற்காக உணவில் இது சேர்க்கப்படுவதாகவும் வதந்திகள் உலாவின. ஆனால், பொட்டாசியம் நைத்திரேட்டுக்கு இவ்வாறான இயல்புகள் இருப்பது குறித்து எவ்வித அறிவியல் சான்றுகளும் இல்லை.[10][11]
குறிப்புகள்
- ERROR: PARAMETER ZVG MISSING in the GESTIS Substance Database from the Institute for Occupational Safety and Health (IFA), accessed on 2007-03-09
- B. J. Kosanke, B. Sturman, K. Kosanke, I. von Maltitz, T. Shimizu, M. A. Wilson, N. Kubota, C. Jennings-White, D. Chapman (2004). "2". Pyrotechnic Chemistry. Journal of Pyrotechnics. பக். 5–6. பன்னாட்டுத் தரப்புத்தக எண்:1889526150. http://books.google.com/books?id=Q1yJNr92-YcC&pg=PA9.
- "Meat Science", University of Wisconsin
- Amthyst Galleries, Inc.
- Inorganic Additives for the Improvement of Tobacco, TobaccoDocuments.org
- Stump Remover MSDS
- "Sensodyne Toothpaste for Sensitive Teeth" (2008-08-03). பார்த்த நாள் 2008-08-03.
- "The Effect of Potassium Nitrate and Silica Dentifrice in the Surface of Dentin". பார்த்த நாள் 2010-07-16.
- Managing dentin hypersensitivity, Robin Orchardson and David G. Gillam, J Am Dent Assoc, Vol 137, No 7, 990-998. 2006
- "The Straight Dope: Does saltpeter suppress male ardor?" (1989-06-16). பார்த்த நாள் 2007-10-19.
- Jones, Richard E.; Kristin H. López (2006). Human Reproductive Biology, Third Edition. Elsevier/Academic Press. பக். 225. பன்னாட்டுத் தரப்புத்தக எண்:0120884658. http://books.google.com/books?id=pfiZfui2XLIC&pg=PA225.
இவற்றையும் பார்க்கவும்
- நைத்திரோசெலுலோசு
- பொட்டாசியம் பேர்குளோரேட்டு
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 |
C | NO− 3, NH4NO3 |
O | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)3, Fe(NO3)2 |
Co(NO3)2, Co(NO3)3 |
Ni(NO3)2 | Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | Br | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru | Rh | Pd(NO3)2 | AgNO3 | Cd(NO3)2 | In | Sn | Sb(NO3)3 | Te | I | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2(NO3)2, Hg(NO3)2 |
Tl(NO3)3, TlNO3 |
Pb(NO3)2 | Bi(NO3)3 BiO(NO3) |
Po | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3, Ce(NO3)4 |
Pr | Nd(NO3)3 | Pm | Sm | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy | Ho | Er | Tm | Yb | Lu | |||
| Ac(NO3)3 | Th(NO3)4 | Pa | UO2(NO3)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||