சிர்க்கோனியம்(III) குளோரைடு
சிர்க்கோனியம்(III) குளோரைடு (Zirconium(III) chloride) என்பது ZrCl3 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மம் ஆகும். கருநீல நிறத்துடன் காணப்படும் இச்சேர்மம் காற்றில் அதிக உணர்திறனுடன் வினைபுரிகிறது.
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
சிர்க்கோனியம் முக்குளோரைடு | |
| இனங்காட்டிகள் | |
| 10241-03-9 | |
| ChemSpider | 127679 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 144719 |
SMILES
| |
| பண்புகள் | |
| Cl3Zr | |
| வாய்ப்பாட்டு எடை | 197.57 g·mol−1 |
| தோற்றம் | Blue-black crystals |
| அடர்த்தி | 3.05 கி/செ.மீ3[1] |
| உருகுநிலை | |
| வினைபுரியும்[1] | |
| கரைதிறன் | பீனைல், CS2 களில் கரையும் |
| கட்டமைப்பு | |
| படிக அமைப்பு | அறுகோணம், hP6[2] |
| புறவெளித் தொகுதி | P63/mcm, No. 193[2] |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
−714.21 கியூ/மோல்l[3] |
| நியம மோலார் எந்திரோப்பி S |
145.79 யூ/மோல்·கெ[3] |
| வெப்பக் கொண்மை, C | 96.21 யூ/மோல்·கெ[3] |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
தயாரிப்பு
சிர்க்கோனியம் நாற்குளோரைடை அலுமினியம் சேர்த்து குறைத்தல் வழியாக சிர்க்கோனியம்(III) குளோரைடு தயாரிக்கப்பட்டது. மாசு கலந்த இச்சேர்மத்தை ஓட்டோ ரஃப் மற்றும் வால்சுடீன் ஆகியோர் தயாரித்தனர்.[4] அடுத்து அலுமினியம் பயன்படுத்துவதால் உண்டாகும் மாசுக்கள் பிரச்சினை, ஒடுக்க வினைக்கு சிர்க்கோனியம் உலோகத்தைப் பயன்படுத்துவதால் நீக்கப்பட்டது.[5]
- Zr + 3 ZrCl4 → 4 ZrCl3
அலுமினியத்தை சிர்க்கோனியம் நாற்குளோரைடுடன் சேர்த்து ஒடுக்கும் முகவராகப் பயன்படுத்தினால், வினையில் தொடர்ச்சியாக குளோரோவலுமினேட்டுகள் உருவாகின்றன.உதாரணமாக[Zr(AlCl4)2(AlCl4)2] and Zr(AlCl4)3.[6]
சிர்க்கோனியம் முக்குளோரைடு போன்ற மூவாலைடுகள் ஒப்பீட்டளவில் எளிதில் ஆவியாவதில்லை. இதனால் வாயுநிலை ஆக்சிசன் ஒடுக்கியைச் சேர்ப்பதால் இம்மாசுச் சீர்கேட்டை தவிர்க்கலாம். உதாரணமாக, சிர்க்கோனியம் முக்குளோரைடை சிர்க்கோனியம் நாற்குளோரைடுடன் ஐதரசன் வாயுவைச் சேர்ப்பதன் மூலம் ஒடுக்க வினையில் தயாரிக்க முடியும்.[7]
- ZrCl4 + ½ H2 → ZrCl3 + HCl
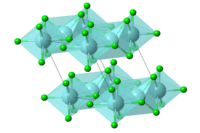
கட்டமைப்பு
சில சிர்க்கோனியம் ஆலைடுகள் (ZrCl3, ZrBr3, and ZrI3) HfI3 சேர்மத்தை ஒத்த கட்டமைப்பைக் கொண்டுள்ளன. ஒரே மாதிரியான இடக்குழு (P63 / MCM) மற்றும் அலகில் 2 மூலக்கூறு அறுங்கோண அமைப்பையும் பெற்றுள்ளன. சிர்க்கோனியம் முக்குளோரைடின் காந்த ஏற்புத்திறன் ஒவ்வொரு Zr(III) மையத்தின் மீதும் இணையில்லா எலக்ட்ரான்களின் உலோக - உலோக இடைவினைகளை பரிந்துரைக்கிறது. ZrCl3 இன் காந்த திருப்புத் திறன் மதிப்பு (0.4 போர் மக்னட்டான்) உலோக ஆர்பிட்டால்களின் கணிசமான மேற்படிதலைக் குறிக்கிறது[2]
மேற்கோள்கள்
- Douglas, Bodie E.; Ho, Shih-Ming (2007). Structure and Chemistry of Crystalline Solids. New York: Springer Science+Business Media, Inc.. பக். 101. பன்னாட்டுத் தரப்புத்தக எண்:0-387-26147-8. http://books.google.com/books?id=hYRCAAAAQBAJ&pg=PA101.
- Zirconium chloride in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov (retrieved 2014-06-23)
- Ruff, Otto; Wallstein, Richard (1923). "Reduktion anorganischer Halogenide III.1) Die Reduktion des Zirkontetrachlorids". Zeitschrift für anorganische und allgemeine Chemie 128: 96. doi:10.1002/zaac.19231280110.
- Hoffman, David M.; Lee, Samkeun (1992). "Synthesis of pyridine complexes of zirconium(III) chloride and the apparent oxidation to zirconium(IV) by a nitrile". Inorganic Chemistry 31 (13): 2675. doi:10.1021/ic00039a002.
- Larsen, E. M.; Moyer, James W.; Gil-Arnao, Francisco.; Camp, Michael J. (1974). "Synthesis of crystalline zirconium trihalides by reduction of tetrahalides in molten aluminum halides. Nonreduction of hafnium". Inorganic Chemistry 13 (3): 574. doi:10.1021/ic50133a015.
- Newnham, I. E.; Watts, J. A. (1960). "The Preparation of the Anhydrous Zirconium Trihalides". Journal of the American Chemical Society 82 (9): 2113. doi:10.1021/ja01494a006.
| குளோரைடுகள் | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HCl | He | ||||||||||||||||||
| LiCl | BeCl2 | BCl3 B2Cl4 |
CCl4 | NCl3 ClN3 |
Cl2O ClO2 Cl2O7 |
ClF ClF3 ClF5 |
Ne | ||||||||||||
| NaCl | MgCl2 | AlCl AlCl3 |
SiCl4 | P2Cl4 PCl3 PCl5 |
S2Cl2 SCl2 SCl4 |
Cl2 | Ar | ||||||||||||
| KCl | CaCl CaCl2 |
ScCl3 | TiCl2 TiCl3 TiCl4 |
VCl2 VCl3 VCl4 VCl5 |
CrCl2 CrCl3 CrCl4 |
MnCl2 | FeCl2 FeCl3 |
CoCl2 CoCl3 |
NiCl2 | CuCl CuCl2 |
ZnCl2 | GaCl2 GaCl3 |
GeCl2 GeCl4 |
AsCl3 AsCl5 |
Se2Cl2 SeCl4 |
BrCl | KrCl | ||
| RbCl | SrCl2 | YCl3 | ZrCl3 ZrCl4 |
NbCl4 NbCl5 |
MoCl2 MoCl3 MoCl4 MoCl5 MoCl6 |
TcCl4 | RuCl3 | RhCl3 | PdCl2 | AgCl | CdCl2 | InCl InCl2 InCl3 |
SnCl2 SnCl4 |
SbCl3 SbCl5 |
Te3Cl2 TeCl4 |
ICl ICl3 |
XeCl XeCl2 | ||
| CsCl | BaCl2 | HfCl4 | TaCl5 | WCl2 WCl3 WCl4 WCl5 WCl6 |
Re3Cl9 ReCl4 ReCl5 ReCl6 |
OsCl4 | IrCl2 IrCl3 IrCl4 |
PtCl2 PtCl4 |
AuCl AuCl3 |
Hg2Cl2, HgCl2 |
TlCl | PbCl2, PbCl4 |
BiCl3 | PoCl2, PoCl4 |
AtCl | RnCl2 | |||
| FrCl | RaCl2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| LaCl3 | CeCl3 | PrCl3 | NdCl2, NdCl3 |
PmCl3 | SmCl2, SmCl3 |
EuCl2, EuCl3 |
GdCl3 | TbCl3 | DyCl2, DyCl3 |
HoCl3 | ErCl3 | TmCl2 TmCl3 |
YbCl2 YbCl3 |
LuCl3 | |||||
| AcCl3 | ThCl4 | PaCl5 | UCl3 UCl4 UCl5 UCl6 |
NpCl4 | PuCl3 | AmCl2 AmCl3 |
CmCl3 | BkCl3 | CfCl3 | EsCl3 | Fm | Md | No | LrCl3 | |||||