কোয়ান্টাম সংখ্যা
এই নিবন্ধ থেকে {{Short description}} সরান। এটি বাংলা উইকিপিডিয়ায় কাজ করবে না।.
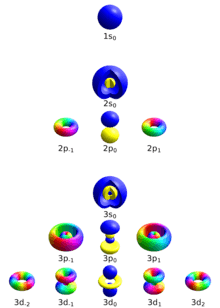
| কোয়ান্টাম বলবিজ্ঞান | ||
শ্রোডিঙ্গারের সমীকরন এর হ্যামিলটনীয় রুপ | ||
|
ভূমিকা | ||
| ||
| ||
| ||
| ||
| ||
| ||
যে সকল রাশি বা সংখ্যা দ্বারা পরমাণুতে ইলেকট্রনের কক্ষপথ বা শক্তি স্তরের আকার ও আকৃতি, ত্রিমাত্রিক বিন্যাস এবং ইলেকট্রনের কক্ষপথের অক্ষ বরাবর স্পিন বা আবর্তন গতি সম্পর্কে তথ্য পাওয়া যায় তাকে কোয়ান্টাম সংখ্যা বলে।
কোয়ান্টাম বলবিদ্যা অনুসারে পরমাণুর ইলেকট্রনের কক্ষপথ বা শক্তিস্তরের আকার, কক্ষপথের আকৃতি ও কক্ষ পথের ত্রিমাত্রিক দিক বিন্যাস নির্দেশক পরস্পর বরাবর ঘূর্ণন প্রকাশক চারটি রাশি আছে। এ চারটি রাশিকে কোয়ান্টাম সংখ্যা বলে । কোয়ান্টাম সংখ্যা প্রধানত চারটি। এর মাধ্যমে ইলেকট্রন এর অবস্থান জানা যায়।
কোয়ান্টাম সংখ্যার প্রকারভেদ
১. প্রধান কোয়ান্টাম সংখ্যা(n)
- যে কোয়ান্টাম সংখ্যার সাহায্যে পরমাণুতে অবস্থিত ইলেকট্রনের শক্তিস্তরের আকার নির্ণয় করা যায় তাকে প্রধান কোয়ান্টাম সংখ্যা বলে। একে n দ্বারা প্রকাশ করা হয়,n এর মান যযথাক্রমে 1,2,3,4..... প্রভৃতি পূর্ণ সংখ্যা।প্রধান কোয়ান্টাম সংখ্যার মান বৃদ্ধি হলে নিউক্লিয়াস হতে প্রধান স্তরের দুরত্ব এবং শক্তিস্তরের আকার বৃদ্ধি পায়। বোর মতবাদ অনুসারে n=1 হলে ১ম শক্তিস্তর বা K শেল, n=2 হলে ২য় শক্তিস্তর বা L শেল, n=3 এবং n=4 হলে M ও N ইত্যাদি বোঝায়। যে কোনো প্রধান শক্তিস্তর সর্বোচ্চ 2n^2 ইলেকট্রন ধারন করতে পারে।
২. গৌন কোয়ান্টাম সংখ্যা(l)
- যে কোয়ান্টাম সংখ্যার সাহায্যে শক্তিস্তরের আকৃতি নির্নয় করা যায় তাকে সহকারী কোয়ান্টাম সংখ্যা বলে। সহকারি কোয়ান্টাম সংখ্যা , এখন এর মান থেকে পর্যন্ত হতে পারে। বোরের তত্ত্বে পরমাণু ছিল বর্তুলাকার। কিন্তু সমারফিল্ড দেখান যে কক্ষপথ উপবৃত্তাকারও হতে পারে। তাছাড়া, হাইড্রোজেন পরমাণুর বর্ণালীর প্রতিটি রেখা আসলে ক্ষুদ্র ক্ষুদ্র অংশে বিভক্ত ছিলো। সমারফিল্ড বললেন যে প্রতিটি অরবিট বা প্রধান শক্তিস্তর সংখ্যক ভাগে বিভক্ত যাদের মধ্যে শক্তির সূক্ষ্ম পার্থক্য আছে। এর ফলেই সূক্ষ্ম রেখাগুলো দেখা যায়।
৩. চৌম্বকীয় কোয়ান্টাম সংখ্যা (m)
- যে সকল কোয়ান্টাম সংখ্যার সাহায্যে ইলেকট্রনের কক্ষপথের ত্রিমাতৃক দিক বিন্যাস প্রকরণ সমূহ প্রকাশ করা হয়, তাকে ম্যাগনেটিক কোয়ান্টাম সংখ্যা বা চুম্বকীয় কোয়ান্টাম সংখ্যা বলে। চুম্বকীয় কোয়ান্টাম সংখ্যা, m এর মান -l থেকে l এর পর্যন্ত পূর্ণসংখ্যা। নন-ডিজেনারেট অবস্থায় অরবিটালসমূহ সমশক্তির, তবে চুম্বকক্ষেত্রে রাখলে শক্তির পার্থক্য তৈরি হয়। আর বলা বাহুল্য, z অক্ষ বরাবর অরবিটাল, যেমন p_z, d-z² এর বেলায় m=0
৪. ঘূর্ণন কোয়ান্টাম সংখ্যা(s)
- নিজস্ব অক্ষের চারদিকে ইলেকট্রনের ঘুর্ণনের দিক প্রকাশক কোয়ান্টাম সংখ্যা সমূহকে স্পিন কোয়ান্টাম সংখ্যা বা ঘূর্ণন কোয়ান্টাম সংখ্যা বলে। এই কোয়ান্টাম সংখ্যা, s, ফার্মিয়ন কণার বেলায় তা ±½ এর গুণিতক। ইলেক্ট্রনের বেলায় তা ½.
কোয়ান্টাম উপস্তরের শক্তিক্রম
অরবিট
বোর পরমাণুবাদ মতে নিউক্লিয়াসের চারপাশে ইলেকট্রন কতগুলো কক্ষপথে/শক্তিস্তরে আবর্তিত হয় । এদের অরবিটাল বলে। প্রতিটি শক্তিস্তরে নির্দিষ্ট সংখ্যক (2n2) ইলেকট্রন থাকে। কোয়ান্টাম মতবাদের উপর ভিত্তি করেই অরবিটের ধারণা প্রতিষ্ঠিত।
অরবিটাল
পরমাণুর ভেতর যে ত্রিমাত্রিক জায়গা জুড়ে ইলেকট্রন এর ঘনত্ব বেশি, তাই অরবিটাল ।
নীতি
এখানে আদর্শ কোনো মান নেই mℓ এবং ms ব্যাতিত. Rather, the mℓ and ms values are arbitrary. The only requirement is that the naming schematic used within a particular set of calculations or descriptions must be consistent (e.g. the orbital occupied by the first electron in a p orbital could be described as mℓ = −1 or mℓ = 0 or mℓ = 1, but the mℓ value of the next unpaired electron in that orbital must be different; yet, the mℓ assigned to electrons in other orbitals again can be mℓ = −1 or mℓ = 0 or mℓ = 1).
এই নিয়মগুলো অনুসরণ করা হয় :
নাম প্রতীক অরবিটাল ব্যাখ্যা মান উদাহরণ প্রধান কোয়ান্টাম সংখ্যা(n) n শেল 1 ≤ n n = 1, 2, 3, … সহকারি কোয়ান্টাম সংখ্যা(l) (angular momentum) ℓ সাব শেল (s orbital is listed as 0, p orbital as 1 etc.) 0 ≤ ℓ ≤ n − 1 for n = 3:
ℓ = 0, 1, 2 (s, p, d)চৌম্বকীয় কোয়ান্টাম সংখ্যা (m) (projection of angular momentum) mℓ energy shift (orientation of the subshell's shape) −ℓ ≤ mℓ ≤ ℓ for ℓ = 2:
mℓ = −2, −1, 0, 1, 2ঘূর্ণন কোয়ান্টাম সংখ্যা(s) ms spin of the electron (−12 = "spin down", 12 = "spin up") −s ≤ ms ≤ s for an electron s = 12,
so ms = −12, +12
Example: The quantum numbers used to refer to the outermost valence electrons of a carbon (C) atom, which are located in the 2p atomic orbital, are; n = 2 (2nd electron shell), ℓ = 1 (p অরবিটাল subshell), mℓ = 1, 0, −1, ms = 12 (parallel spins).
Results from spectroscopy indicated that up to two electrons can occupy a single orbital. However two electrons can never have the same exact quantum state nor the same set of quantum numbers according to Hund's rules, which addresses the Pauli exclusion principle. A fourth quantum number with two possible values was added as an ad hoc assumption to resolve the conflict; this supposition could later be explained in detail by relativistic quantum mechanics and from the results of the renowned Stern–Gerlach experiment.
শক্তিস্তরে ইলেক্ট্রন সংখ্যা অনুসারে মৌলিক পদার্থের তালিকা
| পারমাণবিক সংখ্যা | মৌল | প্রতি শক্তিস্তরে ইলেক্ট্রন সংখ্যাll | শ্রেণী |
|---|---|---|---|
| ১ | হাইড্রোজেন | ১ | ১ |
| ২ | হিলিয়াম | ২ | ১৮ |
| ৩ | লিথিয়াম | ২, ১ | ১ |
| ৪ | বেরিলিয়াম | ২, ২ | ২ |
| ৫ | বোরন | ২, ৩ | ১৩ |
| ৬ | কার্বন | ২, ৪ | ১৪ |
| ৭ | নাইট্রোজেন | ২, ৫ | ১৫ |
| ৮ | অক্সিজেন | ২, ৬ | ১৬ |
| ৯ | ফ্লোরিন | ২, ৭ | ১৭ |
| ১০ | নিয়ন | ২, ৮ | ১৮ |
| ১১ | সোডিয়াম | ২, ৮, ১ | ১ |
| ১২ | ম্যাগণেসিয়াম | ২, ৮, ২ | ২ |
| ১৩ | অ্যালুমিনিয়াম | ২, ৮, ৩ | ১৩ |
| ১৪ | সিলিকন | ২, ৮, ৪ | ১৪ |
| ১৫ | ফসফরাস | ২, ৮, ৫ | ১৫ |
| ১৬ | সালফার | ২, ৮, ৬ | ১৬ |
| ১৭ | ক্লোরিন | ২, ৮, ৭ | ১৭ |
| ১৮ | আর্গণ | ২, ৮, ৮ | ১৮ |
| ১৯ | পটাশিয়াম | ২, ৮, ৮, ১ | ১ |
| ২০ | Calcium | ২, ৮, ৮, ২ | ২ |
| ২১ | Scandium | ২, ৮, ৯, ২ | ৩ |
| ২২ | Titanium | ২, ৮, ১0, ২ | ৪ |
| ২৩ | Vanadium | ২, ৮, ১১, ২ | ৫ |
| ২৪ | Chromium | ২, ৮, ১৩, ১ | ৬ |
| ২৫ | Manganese | ২, ৮, ১৩, ২ | ৭ |
| ২৬ | Iron | ২, ৮, ১৪, ২ | ৮ |
| ২৭ | Cobalt | ২, ৮, ১৫, ২ | 9 |
| ২৮ | Nickel | ২, ৮, ১৬, ২ | ১0 |
| ২৯ | Copper | ২, ৮, ১৮, ১ | ১১ |
| ৩০ | Zinc | ২, ৮, ১৮, ২ | ১২ |
| ৩১ | Gallium | ২, ৮, ১৮, ৩ | ১৩ |
| ৩২ | Germanium | ২, ৮, ১৮, ৪ | ১৪ |
| ৩৩ | Arsenic | ২, ৮, ১৮, ৫ | ১৫ |
| ৩৪ | Selenium | ২, ৮, ১৮, ৬ | ১৬ |
| ৩৫ | Bromine | ২, ৮, ১৮, ৭ | ১৭ |
| ৩৬ | Krypton | ২, ৮, ১৮, ৮ | ১৮ |
| ৩৭ | Rubidium | ২, ৮, ১৮, ৮, ১ | ১ |
| ৩৮ | Strontium | ২, ৮, ১৮, ৮, ২ | ২ |
| ৩৯ | Yttrium | ২, ৮, ১৮, ৯, ২ | ৩ |
| ৪০ | Zirconium | ২, ৮, ১৮, ১0, ২ | ৪ |
| ৪১ | Niobium | ২, ৮, ১৮, ১২, ১ | ৫ |
| ৪২ | Molybdenum | ২, ৮, ১৮, ১৩, ১ | ৬ |
| ৪৩ | Technetium | ২, ৮, ১৮, ১৩, ২ | ৭ |
| ৪৪ | Ruthenium | ২, ৮, ১৮, ১৫, ১ | ৮ |
| ৪৫ | Rhodium | ২, ৮, ১৮, ১৬, ১ | 9 |
| ৪৬ | Palladium | ২, ৮, ১৮, ১৮ | ১0 |
| ৪৭ | Silver | ২, ৮, ১৮, ১৮, ১ | ১১ |
| ৪৮ | Cadmium | ২, ৮, ১৮, ১৮, ২ | ১২ |
| ৪৯ | Indium | ২, ৮, ১৮, ১৮, ৩ | ১৩ |
| ৫০ | Tin | ২, ৮, ১৮, ১৮, ৪ | ১৪ |
| ৫১ | Antimony | ২, ৮, ১৮, ১৮, ৫ | ১৫ |
| ৫২ | Tellurium | ২, ৮, ১৮, ১৮, ৬ | ১৬ |
| ৫৩ | Iodine | ২, ৮, ১৮, ১৮, ৭ | ১৭ |
| ৫৪ | Xenon | ২, ৮, ১৮, ১৮, ৮ | ১৮ |
| ৫৫ | Caesium | ২, ৮, ১৮, ১৮, ৮, ১ | ১ |
| ৫৬ | Barium | ২, ৮, ১৮, ১৮, ৮, ২ | ২ |
| ৫৭ | Lanthanum | ২, ৮, ১৮, ১৮, ৯, ২ | |
| ৫৮ | Cerium | ২, ৮, ১৮, ১৯, ৯, ২ | |
| ৫৯ | Praseodymium | ২, ৮, ১৮, ২১, ৮, ২ | |
| ৬০ | Neodymium | ২, ৮, ১৮, ২২, ৮, ২ | |
| ৬১ | Promethium | ২, ৮, ১৮, ২৩, ৮, ২ | |
| ৬২ | Samarium | ২, ৮, ১৮, ২৪, ৮, ২ | |
| ৬৩ | Europium | ২, ৮, ১৮, ২৫, ৮, ২ | |
| ৬৪ | Gadolinium | ২, ৮, ১৮, ২৫, ৯, ২ | |
| ৬৫ | Terbium | ২, ৮, ১৮, ২৭, ৮, ২ | |
| ৬৬ | Dysprosium | ২, ৮, ১৮, ২৮, ৮, ২ | |
| ৬৭ | Holmium | ২, ৮, ১৮, ২৯, ৮, ২ | |
| ৬৮ | Erbium | ২, ৮, ১৮, ৩0, ৮, ২ | |
| ৬৯ | Thulium | ২, ৮, ১৮, ৩১, ৮, ২ | |
| ৭০ | Ytterbium | ২, ৮, ১৮, ৩২, ৮, ২ | |
| ৭১ | Lutetium | ২, ৮, ১৮, ৩২, ৯, ২ | ৩ |
| ৭২ | Hafnium | ২, ৮, ১৮, ৩২, ১0, ২ | ৪ |
| ৭৩ | Tantalum | ২, ৮, ১৮, ৩২, ১১, ২ | ৫ |
| ৭৪ | টাংস্টেন | ২, ৮, ১৮, ৩২, ১২, ২ | ৬ |
| ৭৫ | Rhenium | ২, ৮, ১৮, ৩২, ১৩, ২ | ৭ |
| ৭৬ | Osmium | ২, ৮, ১৮, ৩২, ১৪, ২ | ৮ |
| ৭৭ | Iridium | ২, ৮, ১৮, ৩২, ১৫, ২ | ৯ |
| ৭৮ | প্লাটিনাম | ২, ৮, ১৮, ৩২, ১৭, ১ | ১০ |
| ৭৯ | সোনা | ২, ৮, ১৮, ৩২, ১৮, ১ | ১১ |
| ৮০ | Mercury | ২, ৮, ১৮, ৩২, ১৮, ২ | ১২ |
| ৮১ | Thallium | ২, ৮, ১৮, ৩২, ১৮, ৩ | ১৩ |
| ৮২ | সীসা | ২, ৮, ১৮, ৩২, ১৮, ৪ | ১৪ |
| ৮৩ | বিসমাথ | ২, ৮, ১৮, ৩২, ১৮, ৫ | ১৫ |
| ৮৪ | Polonium | ২, ৮, ১৮, ৩২, ১৮, ৬ | ১৬ |
| ৮৫ | Astatine | ২, ৮, ১৮, ৩২, ১৮, ৭ | ১৭ |
| ৮৬ | Radon | ২, ৮, ১৮, ৩২, ১৮, ৮ | ১৮ |
| ৮৭ | Francium | ২, ৮, ১৮, ৩২, ১৮, ৮, ১ | ১ |
| ৮৮ | Radium | ২, ৮, ১৮, ৩২, ১৮, ৮, ২ | ২ |
| ৮৯ | Actinium | ২, ৮, ১৮, ৩২, ১৮, ৯, ২ | |
| ৯০ | Thorium | ২, ৮, ১৮, ৩২, ১৮, ১0, ২ | |
| ৯১ | Protactinium | ২, ৮, ১৮, ৩২, ২0, ৯, ২ | |
| ৯২ | Uranium | ২, ৮, ১৮, ৩২, ২১, ৯, ২ | |
| ৯৩ | Neptunium | ২, ৮, ১৮, ৩২, ২২, ৯, ২ | |
| ৯৪ | Plutonium | ২, ৮, ১৮, ৩২, ২৪, ৮, ২ | |
| ৯৫ | Americium | ২, ৮, ১৮, ৩২, ২৫, ৮, ২ | |
| ৯৬ | Curium | ২, ৮, ১৮, ৩২, ২৫, ৯, ২ | |
| ৯৭ | Berkelium | ২, ৮, ১৮, ৩২, ২৭, ৮, ২ | |
| ৯৮ | Californium | ২, ৮, ১৮, ৩২, ২৮, ৮, ২ | |
| ৯৯ | Einsteinium | ২, ৮, ১৮, ৩২, ২৯, ৮, ২ | |
| ১০০ | Fermium | ২, ৮, ১৮, ৩২, ৩0, ৮, ২ | |
| ১০১ | Mendelevium | ২, ৮, ১৮, ৩২, ৩১, ৮, ২ | |
| ১০২ | Nobelium | ২, ৮, ১৮, ৩২, ৩২, ৮, ২ | |
| ১০৩ | Lawrencium | ২, ৮, ১৮, ৩২, ৩২, ৮, ৩ (?) | ৩ |
| ১০৪ | Rutherfordium | ২, ৮, ১৮, ৩২, ৩২, ১0, ২ | ৪ |
| ১০৫ | Dubnium | ২, ৮, ১৮, ৩২, ৩২, ১১, ২ | ৫ |
| ১০৬ | Seaborgium | ২, ৮, ১৮, ৩২, ৩২, ১২, ২ | ৬ |
| ১০৭ | Bohrium | ২, ৮, ১৮, ৩২, ৩২, ১৩, ২ | ৭ |
| ১০৮ | Hassium | ২, ৮, ১৮, ৩২, ৩২, ১৪, ২ | ৮ |
| ১০৯ | Meitnerium | ২, ৮, ১৮, ৩২, ৩২, ১৫, ২ | 9 |
| ১১০ | Darmstadtium | ২, ৮, ১৮, ৩২, ৩২, ১৭, ১ | ১0 |
| ১১১ | Roentgenium | ২, ৮, ১৮, ৩২, ৩২, ১৮, ১ | ১১ |
| ১১২ | Copernicium | ২, ৮, ১৮, ৩২, ৩২, ১৮, ২ | ১২ |
| ১১৩ | Nihonium | ২, ৮, ১৮, ৩২, ৩২, ১৮, ৩ | ১৩ |
| ১১৪ | Flerovium | ২, ৮, ১৮, ৩২, ৩২, ১৮, ৪ | ১৪ |
| ১১৫ | Moscovium | ২, ৮, ১৮, ৩২, ৩২, ১৮, ৫ | ১৫ |
| ১১৬ | Livermorium | ২, ৮, ১৮, ৩২, ৩২, ১৮, ৬ | ১৬ |
| ১১৭ | Tennessine | ২, ৮, ১৮, ৩২, ৩২, ১৮, ৭ (?) | ১৭ |
| ১১৮ | Oganesson | ২, ৮, ১৮, ৩২, ৩২, ১৮, ৮ | ১৮ |