கார்பனேட்டு
வேதியியலில் கார்பனேட்டு (Carbonate) என்பது கார்போனிக் அமிலத்தினுடைய உப்பு ஆகும். 'இது கார்பனேட்டு அயனியைப் CO32- கொண்டிருக்கும் என அடையாளப்படுத்தப்படுகிறது. C(=O)(O–)2 என்ற கார்பனேட்டுத் தொகுதியைக் கொண்டுள்ள கரிமச் சேர்மம் என்றும் கார்போனிக் அமிலத்தின் எசுத்தர் என்ற வேறு பெயர்களாலும் கார்பனேட்டு அழைக்கப்படுகிறது.
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
கார்பனேட்டு | |
| முறையான ஐயூபிஏசி பெயர்
டிரை ஆக்சிடோகார்பனேட்டு[1]:127 | |
| இனங்காட்டிகள் | |
| 3812-32-6 | |
| ChemSpider | 18519 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 19660 |
SMILES
| |
| UNII | 7UJQ5OPE7D |
| பண்புகள் | |
| CO2− 3 | |
| வாய்ப்பாட்டு எடை | 60.01 g·mol−1 |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| Infobox references | |
கார்பனேட்டு என்ற பெயர்ச்சொல் கார்பன் டை ஆக்சைடு ஏற்றம் என்ற வினையையும் குறிப்பதால் இச்சொல் ஒரு வினைச் சொல்லாகவும் பயன்படுத்தப்படுகிறது. தண்ணீரில் கார்பனேட்டு மற்றும் பைகார்பனேட்டு போன்ற அயனிகளின் செறிவை அதிகரிக்கும் செயல்முறையை பொதுவாக கார்பனேற்றம் என்பர். கார்பன் டை ஆக்சைடு ஏற்றப்பட்ட நீர் வர்த்தக ரீதியாக சோடா என்ற பெயரால் அழைக்கப்படுகிறது. இதைத் தயாரிக்க அழுத்தத்திற்கு உட்படுத்தி கார்பன் டை ஆக்சைடை தண்ணிருடன் சேர்க்கிறார்கள். அல்லது கார்பனேட்டு அல்லது பை கார்பனேட்டை தண்ணீரில் கரைக்கிறார்கள்.
நிலவியலிலும் கனிமவியலிலும் கார்பனேட்டு என்ற பெயர்ச்சொல் கார்பனேட்டு கனிமங்களையும் கார்பனேட்டு பாறைகளையும் குறிக்கிறது. கார்பனேட்டு பாறைகள் பொதுவாக கார்பனேட்டு கனிமங்களால் ஆனது ஆகும். இவ்விரண்டிலுமே கார்பனேட்டு அயனிகள் CO2−3 மிகுந்து காணப்படுகின்றன. கார்பனேட் தாதுக்கள் மிகவும் மாறுபட்டவைகளாக உள்ளன. வேதியியல் ரீதியாக வீழ்படிவாக்கப்பட்ட வண்டல் பாறைகளில் எங்கும் காணப்படுகின்றன.
கால்சைட்டு அல்லது கால்சியம் கார்பனேட்டு (CaCO3) என்றழைக்கப்படும் கனிமம் மிகப் பொதுவானது ஆகும். சுண்ணாம்புக் கல்லின் முதன்மையான பகுதிப்பொருளாக இது உள்ளது. இதேபோல மெல்லுடலிகளின் மேலோட்டிலும் பவளக் கூட்டிலும் கால்சியம் கார்பனேட்டு காணப்படுகிறது. டோலமைட்டு என்ற கனிமமும் ஒரு கால்சியம் மக்னீசியம் கார்பனேட்டு ஆகும். சிடரைட்டு என்று அழைக்கப்படும் முக்கியமான இரும்பின் கனிமம் இரும்பு(II) கார்பனேட்டைக் (FeCO3) குறிக்கும். சோடியம் கார்பனேட்டும் பொட்டாசியம் கார்பனேட்டும் பண்டைக்காலம் முதல் தூய்மைப்படுத்தல், பாதுகாத்தல் மற்றும் கண்ணாடி தயாரித்தல் போன்ற செயல்முறைகளில் பயன்படுத்தப்பட்டு வருகின்றன. மேலும் கார்பனேட்டுகள் பொதுவாக இரும்பு, சிமெண்ட் , சுண்ணாம்பு தயாரிக்கும் தொழிற்சாலைகளில் பயன்படுத்தப்பட்டு வருகின்றன.
கட்டமைப்பும் பிணைப்பும்

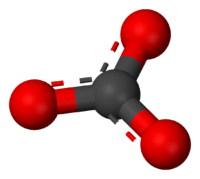
3) பந்து-குச்சி மாதிரி உருவம்
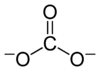
கார்பனேட்டு அயனி மிகவும் எளிய ஆக்சோகார்பன் எதிர்மின் அயனியாகும். இதில் ஒரு கார்பன் அணுவைச் சுற்றி மூன்று ஆக்சிசன் அணுக்கள் முக்கோண சமதள அமைப்பில் D3h மூலக்கூற்று வடிவத்தில் சூழ்ந்துள்ளன. இதன் மூலக்கூற்று நிறை 60.01 கிராம்/மோல் ஆகும். ஒட்டுமொத்த மின்சுமை -2 என கணக்கிடப்பட்டுள்ளது. கார்பனேட்டு அயனி ஐதரசன் கார்பனேட்டின் (HCO−3,) இணைகாரமாகும். பைகார்பனேட்டானது காபானிக் அமிலத்தின் ( H2CO3 ) இணைகாரமாகும். கார்பனேட்டின் லூயிசு கட்டமைப்பில் இரண்டு நீண்ட ஒற்ரைப் பிணைப்புகள் எதிர்மின் ஆக்சிசன் அணுக்களுடனும் ஒரு குட்டையான இரட்டைப் பிணைப்பு நடுநிலை ஆக்சிசனுடனும் பிணைந்துள்ளன.
இந்தக் கட்டமைப்பு அயனியின் அனுசரிக்கப்பட்ட சமச்சீருடன் பொருந்தாது, மூன்று பிணைப்புகளும் சமமாக நீளம் கொண்டவை என்றும் மூன்று ஆக்சிசன் அணுக்களும் சமமானவை என்றும் சீர்மை குறிக்கிறது. ஒத்த எலக்ட்ரான் நைட்ரேட்டு அயனியைப் பொறுத்தவரை மூன்று அமைப்புகளுக்கும் இடையேயான ஒத்ததிர்வு மூலம் சமச்சீர் நிலையை அடைய முடியும்.
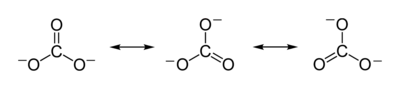
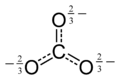
இந்த ஒத்ததிர்வை பகுதிப் பிணைப்புகள் மற்றும் உள்ளடங்கா மின்சுமைகள் அடங்கிய ஒரு மாதிரியாகத் தொகுத்துக் கூறலாம்.
வேதிப் பண்புகள்
உலோகக் கார்பனேட்டுகள் பொதுவாக வெப்பத்தில் சிதைவடைகின்றன. நீண்டகால கார்பன் சுழற்சியிலிருந்து கார்பன் டை ஆக்சைடை விடுவித்து குறுகிய கால கார்பன் சுழற்சிக்கு மாறுகின்றன. உலோக ஆக்சைடு எஞ்சி நிற்கிறது . இச்செயல்முறை கால்சினேற்றம் என்ற பெயரால் அழைக்கப்படுகிறது. கால்சியம் ஆக்சைடிற்கு இலத்தீன் மொழியில் கால்க்சு என்று பெயராகும். சுண்ணாம்புக் கல்லை செங்கற்சூலையில் இட்டு வறுத்தல் மூலம் கால்க்சு தயாரிக்கப்படுகிறது
நேர்மின் சுமை கொண்ட M+, M2+ , அல்லது M3+ , அயனிகள் எதிர்மின் சுமை கொண்ட ஆக்சிசன் அணுக்களுடன் நிலைமின் ஈர்ப்பு விசைகளால் ஈர்க்கப்பட்டு கார்பனேட்டு என்ற அயனிச் சேர்மமாக உருவாகிறது.
- 2 M+
+ CO2−
3 → M
2CO
3
- M2+
+ CO2−
3 → MCO
3
- 2 M3+
+ 3 CO2−
3 → M
2(CO
3)
3
பெரும்பாலான கார்பனேட்டு உப்புக்கள் திட்ட வெப்பநிலை மற்றும் அழுத்தத்தில் தண்ணீரில் நிலையான வெப்பநிலை மற்றும் அழுத்தத்தில் கரைவதில்லை. 1 × 10-8 என்ற அளவுக்கும் குறைவான கரைதிறன் மாறிலியை இவை பெற்றுள்ளன. இலித்தியம், சோடியம், பொட்டாசியம் மற்றும் அம்மோனியம் கார்பனேட்டுகள் மற்றும் இவற்றுடன் பல யுரேனிய கார்பனேட்டுகளும் விதிவிலக்காக தண்ணீரில் கரைகின்றன.
நீரிய கரைசலில், கார்பனேட்டு, பைகார்பனேட்டு, கார்பன் டை ஆக்சைடு மற்றும் கார்போனிக் அமிலம் ஆகியவை இயங்குச் சமநிலையில் ஒன்றாக உள்ளன. வலிமையான கார நிபந்தனைகளில் கார்பனெட்டு அயனி ஆதிக்கம் செலுத்துகிறது. வலிமை குறைந்த கார நிபந்தனைகளில் பைகார்பனேட்டு அயனி எங்கும் காணப்படுகிறது. அதிகமான அமிலத்தன்மையில் நீரிய கார்பன் டை ஆக்சைடு CO2 (நீரிய), பிரதானமான முக்கிய வடிவம் ஆகும், இது நீர் (H2O) மற்றும் கார்பானிக் அமிலத்துடன் சமநிலையில் உள்ளது. இச்சமநிலை கார்பன் டை ஆக்சைடை நோக்கி வலுவாக உள்ளது. இதன்படி சோடியம் கார்பனேட்டு காரமாகவும் சோடியம் பைகார்பனேட்டு பலவீனமான காரமாகவும் கருதப்படுகிறது. கார்பன் டை ஆக்சைடும் தன்னளவில் ஒரு பலவீனமான அமிலம் ஆகும். கார்பன் டை ஆக்சைடை அழுத்தத்திற்கு உட்படுத்தி நீரில் கரைத்து கார்பனேற்றப்பட்ட நீர் தயாரிக்கப்படுகிறது. சோடா புட்டியின் கோலி திறக்கப்படும் போது CO2 இன் ஒரு பகுதி அழுத்தம் குறைக்கப்படுகிறது. கார்பனேட்டு, பைகார்பனேட்டு, கார்பன் டை ஆக்சைடு மற்றும் கார்பானிக் அமில வடிவம் ஒவ்வொன்றின் சமநிலையும் அந்த வெப்பநிலை மற்றும் அழுத்தத்தில் CO2 வாயுவின் செறிவைப் பொறுத்து மாறுகிறது. வாழ்க்கை முறைகளில் கார்பானிக் அன் ஐதரேசு என்ற நொதி CO2 மற்றும் கார்பானிக் அமிலத்தின் மாறும் வேகத்தை அதிகரிக்கிறது.
பெரும்பாலான உலோகங்களின் கார்பனேட்டு உப்புகள் தண்ணீரில் கரையக்கூடியதாக இல்லாவிட்டாலும், பைகார்பனேட்டு உப்புகளில் இது உண்மை இல்லை. கரைசலில் கார்பனேட்டு, பைகார்பனேட்டு, கார்பன் டை ஆக்சைடு மற்றும் கார்பானிக் அமிலம் ஆகியவற்றிற்கு இடையில் வெப்பம் மற்றும் அழுத்தத்திற்கு ஏற்ப இந்த சமநிலை மாறுகிறது. கரையாத கார்பனேட்டுகளுடன் கூடிய உலோக அயனிகளில், எ.கா. CaCO3, கரையாத சேர்மங்கள் உருவாகின்றன. கடின நீரால் ஏற்படுகின்ற குழாய்களின் அடைப்புக்கு இதுவே விளக்கமாகும்.
கனிமவேதியியல் பெயரிடலில் கார்பனேட்டு
ஐயுபிஏசி முறையில் கார்பனேட்டு டிரை ஆக்சிடோகார்பனேட்டு (2-) எனப்பெயரிடப்படுகிறது. இதேபோல சயனைடு எதிர்மின் அயனியும் நைட்ரிடோ கார்பனேட்டு எனப்படுகிறது. இதே முறையைப் பின்பற்றி கார்பனேட்டு (4−) கார்பைடு எதிர்மின் அயனி எனப்படுகிறது.
கரிம கார்பனேட்டுகள்
கரிம வேதியியல் கார்பனேட்டு என்பது ஒரு வேதி வினைக்குழுவாகக் கருதப்படுகிறது. ஒரு பெரிய மூலக்கூறுக்குள் ஒரு கார்பன் அணு மூன்று ஆக்சிசன் அணுக்களுடன் இணைந்திருக்கும் நிலையை இது குறிக்கிறது. இதில் ஒன்று இரட்டை பிணைப்பாகும். இவை கரிமகார்பனேட்டுகள் அல்லது கார்பனேட்டு எசுத்தர்கள் எனப்படுகின்றன. ROCOOR′, அல்லது RR′CO3 என்ற பொதுவாய்ப்பாட்டை இவை பெற்றுள்ளன. டைமெத்தில் கார்பனேட்டு, வளைய சேர்மங்களான எத்திலீன் கார்பனேட்டு, புரோப்பைலீண் கார்பனேட்டு, டிரைபாசுகீன் போன்றவை கரிமகார்பனேட்டுகளுக்கு உதாரணங்களாகும்.
உயிரியல் முக்கியத்துவம்
இரத்தத்தில் இது தாங்கல் கரைசலாகச் செயல்படுகிறது. pH குறைவாக இருக்கும் போது ஐதரசன் அயனிகளின் அடர்த்தி அதிகமாக உள்ளது.
pH அதிகமாக உள்ளபோது ஐதரசன் அயனிகளின் அடர்த்தி குறைவாக உள்ளது. எனவே சிறுநீரகங்கள் பைகார்பனேட்டை வெளியேற்றுகின்றன.
மூன்று முக்கியமான மீள் வினைகள் pH சமநிலையை கட்டுபடுத்துகின்றன.
1. H2CO3(aq) ⇌ H+(aq) + HCO−3(aq)
2. H2CO3(aq) ⇌ CO2(aq) + H2O(l)
3. CO2(aq) ⇌ CO2(g)
CO2 (வாயு) வெளியேற்றும் போது CO2 (நீரிய), வைக் குறைத்து H2CO3 சேர்மத்தை பயன்படுத்திக் கொள்கிறது. இதனால் முதல் வினையில் லி சாட்லியர் கொள்கை மேற்கூறிய மாற்றத்தை ஏற்படுத்துகிறது. அதே கொள்கையில், pH மிக அதிகமாக இருக்கும் போது, சிறுநீரகங்கள் பைகார்பனேட்டை சிறுநீரில் யூரியா சுழற்சியாக வெளியேற்றுகின்றன. பைகார்பனேட்டை நீக்குவதன் மூலம் அதிக அளவு H + அயனி உருவாகிறது.
.
கார்பனேட்டு உப்புகள்
- கார்பனேட்டு மீள்பார்வை:
| H2CO3 | He | |||||||||||||||||
| Li2CO3 | BeCO3 | B | C | N | O | F | Ne | |||||||||||
| Na2CO3 | MgCO3 | Al2(CO3)3 | Si | P | S | Cl | Ar | |||||||||||
| K2CO3 | CaCO3 | Sc | Ti | V | Cr | MnCO3 | FeCO3 | CoCO3 | NiCO3 | CuCO3 | ZnCO3 | Ga | Ge | As | Se | Br | Kr | |
| Rb2CO3 | SrCO3 | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag2CO3 | CdCO3 | In | Sn | Sb | Te | I | Xe | |
| Cs2CO3 | BaCO3 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl2CO3 | PbCO3 | Bi | Po | At | Rn | ||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||
| ↓ | ||||||||||||||||||
| La2(CO3)3 | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
புவிக்கு அப்பால் கார்பனேட்டுகள்
நீர்ம நிலையில் தண்ணீர் இருக்கிறது என்பதை உறுதிப்படுத்துவதற்கு பாறைகளில் கார்பனேட்டு இருப்பது பொதுவாக ஒரு வலுவான ஆதாரமாகக் கருதப்படுகிறது. விண்மீன் நெபுலா புபொப 6302 தொடர்பான சமீபத்திய ஆய்வுகள் விண்வெளியில் கார்பனேட்டு இருப்பதற்கான ஆதாரங்களைக் காட்டுகிறது [2], பூமியில் இருப்பது போன்ற நீர்நிலை மாறுபாடுகளுக்கு சாத்தியமில்லை என்றாலும் மற்ற தாதுக்கள் முன்வைக்கப்படுகின்றன.
அண்மையில் நடைபெற்ற செவ்வாய் கிரகத்திற்குள் தொலைதூர உணர்திறன் ஆய்வுகள் மூலமாகவோ அல்லது செவ்வாய் பயணத்திட்ட ஆய்வுகளிலோ கார்பனேட்டு வைப்புக்கள் ஏதும் காணப்படவில்லை, எனினும் மார்டியன் விண்கற்கள் சிறிய அளவு கார்பனேட்டுகளைக் கொண்டுள்ளன. செவ்வாயிலுள்ள கூசெவ் (குழி) [3], மெரிடியானி பிளானம் ஆகிய பகுதிகள் இரண்டிலும் நிலத்தடி நீர் இருந்திருக்கலாம் என நம்பப்படுகிறது [4]
மேற்கோள்கள்
- வார்ப்புரு:RedBookRef
- Kemper, F., Molster, F.J., Jager, C. and Waters, L.B.F.M. (2001) The mineral composition and spatial distribution of the dust ejecta of NGC 6302. Astronomy & Astrophysics 394, 679-690.
- Squyres et al., (2007) doi 10.1126/science.1139045
- Squyres et al., (2006) doi 10.1029/2006JE002771