கிடைக்குழு 3 தனிமங்கள்
கிடைக்குழு 3 தனிமங்கள் (Period 3 elements) தனிம வரிசை அட்டவணையில் மூன்றாவது கிடை வரிசையில் இடம்பெற்றுள்ள வேதித் தனிமங்களை குறிக்கிறது. இவை 3 ஆவது தொடர் தனிமங்கள் எனப்படுகின்றன. இது ஒரு குறுகிய தொடராகும். இத்தொடரில் அணு எண் 11 முதல் 18 வரை கொண்ட எட்டு தனிமங்கள் இடம்பெற்றுள்ளன. அவை சோடியம் Na, மக்னீசியம் Mg, அலுமீனியம் Al, சிலிக்கான் Si, பாசுபரசு P, கந்தகம் S, குளோரின் Cl , ஆர்கன் Ar என்பனவாகும். இத் தொடரில் அணு எண் உயர்வதற்கேற்ப அவற்றின் ஆற்றல் கூடுகள் எலக்ட்ரான்களால் ஒரு மந்தவாயு அமைப்பு வரும்வரை முறையாக நிரப்பப்படுகின்றன. இத்தொடரில் உள்ள தனிமங்களின் இயற்பியல் மற்றும் வேதியியல் பண்புகள் ஏறுவரிசையில் அமைந்துள்ள அவற்றின் அணு எண்களுக்கு ஏற்ப ஆவர்த்தன் முறையில் மாற்றமடைகின்றன. இத்தொடரில் உள்ள தனிமங்கள் அவை இடம்பெற்றுள்ள மேலிருந்து கீழாகச் செல்லும் குழுவில் உள்ள தனிமங்களுடன் ஒத்த பண்புகளைப் பெற்றுள்ளன. முதல் இரண்டு தனிமங்களான சோடியமும் மக்னீசியமும் தனிம வரிசை அட்டவனையில் எசு தொகுதி தனிமங்களாகும். மற்ற தனிமங்கள் பி தொகுதியில் இடம்பெறுகின்றன. இத்தொடரின் 3டி துணைக்கூடுகள் 4 ஆவது தொடர் வரையில் நிரப்பப்படாமல் உள்ளன. இதனால் தனிமவரிசை அட்டவணை அடுத்தடுத்த இரண்டு குழுக்கள் தோற்றத்தால் தனிச் சிறப்பு அமைப்பைப் பெறுகிறது. மூன்றாவது தொடரில் உள்ள அனைத்து தனிமங்களும் இயற்கையில் தோன்றுகின்றன. மேலும் இவை குறைந்தபட்சம் ஓர் ஐசோடோப்பையாவது கொண்டுள்ளன [1].
அணு ஆரம்
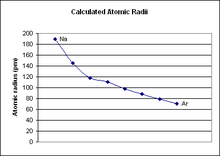
மூன்றாவது தொடரில் உள்ள தனிமங்களின் அணு எண்கள் அதிகரிக்கின்றன. அணு ஆரம் குறைகிறது.
மின்னெதிர்தன்மை
மூன்றாவது தொடரில் உள்ள தனிமங்களின் அணு நிறை அதிகரிக்கிறது. இதனால் மின்னெதிர் தன்மையும் அதிகரிக்கிறது.
அயனியாக்கும் ஆற்றல்
மூன்றாவது தொடரில் உள்ள தனிமங்களின் அணு எண்கள் அதிகரிப்பதால் இவற்றின் எலக்ட்ரான்களை நீக்குவதற்குத் தேவையான அயனியாக்கும் ஆற்றலும் அதிகரிக்கிறது.
தனிமங்கள்
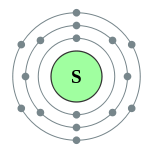
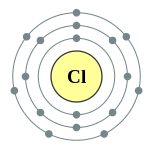
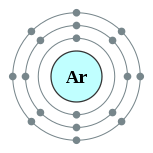
தனிமம் வேதியியல் தொடர் எலக்ட்ரான் அமைப்பு 11 Na சோடியம் கார உலோகங்கள் [Ne] 3s1 12 Mg மக்னீசியம் காரமண் உலோகங்கள் [Ne] 3s2 13 Al அலுமினியம் இடைநிலைத் தனிமங்கள் [Ne] 3s2 3p1 14 Si சிலிக்கான் உலோகப்போலி [Ne] 3s2 3p2 15 P பாசுபரசு அலோகங்கள் [Ne] 3s2 3p3 16 S கந்தகம் அலோகங்கள் [Ne] 3s2 3p4 17 Cl குளோரின் உப்பீனிகள் [Ne] 3s2 3p5 18 Ar ஆர்கன் மந்த வாயு [Ne] 3s2 3p6
சோடியம்
இதன் மூலக்கூற்று வாய்ப்பாடு Na ஆகும். இது மெண்மையான வெள்ளியைப் போன்று மெண்மையான உலோகமாகும். கார உலோகம் என்று இதை வகைப்படுத்துகிறார்கள். அதிக வினைத்திறன் கொண்ட தனிமமாகவும் சோடியம் விளங்குகிறது. 23Na என்ற நிலைப்புத்தன்மை கொண்ட ஒரே ஒரு ஐசோடோப்பை இது கொண்டுள்ளது. பெல்சுபார், சோடாலைட்டு, பாறை உப்பு போன்ற கனிமங்களில் நிறைந்து இயற்கையில் அதிக அளவில் சோடியம் கிடைக்கிறது. சோடியம் உப்புகள் தண்ணீரில் எளிதில் கரையும் என்பதால் இவை பூமியில் உள்ள நீர் நிலைகளில் அதிக அளவில் கிடைக்கின்றன. குறிப்பாக கடல் நீரில் சோடியம் குளோரைடாக இது பெருமளவில் கிடைக்கிறது.
சோடியம் சேர்மங்கள் பல்வேறு பயன்களைத் தருகின்றன. சோடியம் ஐதராக்சைடு சோப்பு தயாரித்தலில் பயன்படுகிறது. சோடியம் குளோரைடு உணவைப் பதப்படுத்தவும், ஊட்டச்சத்தாகவும் பயன்படுத்தப்படுகிறது. தனி உலோகமாக சோடியம் இயற்கையில் கிடைப்பதில்லை. ஆனால் சோடியம் சேர்மங்களில் இருந்து இதை தயாரிக்க முடியும். சர் அம்பரி டேவி 1807 ஆம் ஆண்டில் முதன்முதலில் தனிமநிலை சோடியத்தைப் பிரித்தெடுத்தார். இதற்காக இவர் சோடியம் ஐதராக்சைடை மின்னாற்பகுப்பு செய்தார். சொடியம் அயனி பல கனிமங்களின் பகுதிப்பொருளாக உள்ளது.
மக்னீசியம்
மக்னீசியத்தின் மூலக்கூற்று வாய்ப்பாடு Mg ஆகும். இதன் அணு எண் 12 மற்றும் அணுநிறை 24.31 ஆகும். இது காரமண் உலோகம் என்று வகைப்படுத்தப்படுகிறது. பொதுவாக +2 என்ற ஆக்சிசனேற்ற நிலையில் காணப்படுகிறது. புவியின் மேலோட்டில் அதிகமாகக் கிடைக்கும் தனிமங்களில் இது எட்டாவது இடத்தைப் பெறுகிறது[2] and ninth in the known universe as a whole.[3][4]. ஒட்டுமொத்தமாக பிரபஞ்சத்தில் அதிகமாகக் கிடைக்கும் தனிமங்களில் ஒன்பதாவது இடத்தைப் பிடிக்கிறது. புவியின் நிறையில் இரும்பு, ஆக்சிசன், சிலிக்கான் ஆகிய தனிமங்களை அடுத்து நான்காவது பெரும்பான்மையான பகுதிப் பொருளாக மக்னீசியம் கலந்துள்ளது. மக்னீசியம் சேர்மங்கள் தண்ணிரில் நன்கு கரையும் என்பதால் கடல் நீரில் இது அதிகமாகக் கலந்துள்ளது[5].
அதிக வினைத்திறன் கொண்ட தனிமம் என்பதால் மக்னீசியம் இயற்கையில் தனித்துக் கிடைப்பதில்லை. காற்றில் வினைபுரிந்து தன்னைச் சுற்றி ஒரு வினையறுக்கும் அடுக்கை உருவாக்கிக் கொளவதால் மேற்கொண்டு வினைபுரியாமல் மக்னீசியம் பாதுகாக்கப்படுகிறது. தனி மக்னீசியம் உலோகம் பிரகாசமான வெள்ளை நிற ஒளியுடன் எரிகிறது. மக்னீசியம் உப்புகளை மின்னாற்பகுப்பு செய்வதன் மூலம் மக்னீசியம் தயாரிக்கப்படுகிறது. அலுமினியம் மக்னீசியம் கலப்புலோகங்கள் தயாரிப்பது மக்னீசியம் உலோகத்தின் முக்கியமான பயனாகும். இவை ஒப்பீட்டளவில் இலேசானதாகவும் வலிமை நிறைந்ததாகவும் உள்ளன.
அலுமினியம்
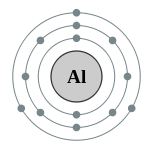
அலுமினியத்தின் மூலக்கூற்று வாய்ப்பாடு Al. வெள்ளியைப் போன்ற வெண்மை நிறத்துடன் இது காணப்படுகிறது. போரான் குழுவைச் சேர்ந்த இது பின் இடைநிலைத் தனிமம் என்று வகைப்படுத்தப்படுகிறது. சாதாராண வெப்ப நிலை மற்றும் அழுத்தத்தில் இது தண்ணிரில் கரைவதில்லை. ஆக்சிசன் மற்றும் சிலிக்கானை அடுத்து மூன்றாவது அதிகமாகக் கிடைக்கும் தனிமம் அலுமினியம் ஆகும். புவியின் நிறை அளவில் 8% அளவு ஆக்சிசன் நிறைந்துள்ளது. 270 வகையான கனிமங்களில் ஒன்றாக அலுமினியம் கலந்துள்ளது. அலுமினியத்தின் முக்கியமான தாது பாக்சைட்டு ஆகும்.
அலுமினியம் அடர்த்தி குறைவானதொரு தனிமம் ஆகும். அதனால் இதன் கலப்புலோகங்கள் ஆகாய விமானங்களின் பாகங்கள் செய்ய பயன்படுத்தப்படுகின்றன. அலுமினியத்தின் ஆக்சைடுகளும் சல்பேட்டுகளும் அதிக அளவில் பயன்படுகின்றன.
மேற்கோள்கள்
- Period 3 Element from Scienceaid.co.uk
- (PDF) Abundance and form of the most abundant elements in Earth's continental crust. http://www.gly.uga.edu/railsback/Fundamentals/ElementalAbundanceTableP.pdf. பார்த்த நாள்: 2008-02-15.
- Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ). Prentice Hall. பக். 305–306. பன்னாட்டுத் தரப்புத்தக எண்:978-0131755536.
- Ash, Russell (2005). The Top 10 of Everything 2006: The Ultimate Book of Lists. Dk Pub. பன்னாட்டுத் தரப்புத்தக எண்:0-7566-1321-3. Archived from the original on 2010-02-10. https://web.archive.org/web/20100210170504/http://plymouthlibrary.org/faqelements.htm.
- Anthoni, J Floor (2006). "The chemical composition of seawater". http://www.seafriends.org.nz/oceano/seawater.htm#composition.