மின்னெதிர்த்தன்மை
மின்னெதிர்த்தன்மை அல்லது எலக்ட்ரான் கவர் திறன் (Electronegativity) என்பது மூலக்கூறொன்றிலுள்ள ஒரு அணுவானது பிணைப்பிலுள்ள இலத்திரன்களை அல்லது இலத்திரன் அடர்த்தியைத் தன்பால் ஈர்த்துக் கொள்ளும் பண்பாகும். இது பயனுடைய அணுக்கரு (தொழிற்படு கருவேற்றம்) மின்சுமை மற்றும் அணு ஆரம் ஆகியவற்றை மின்னெதிர்த்தன்மை அடிப்படையாகக் கொண்டதாகும். பயனுடைய அணுக்கரு மின்சுமை அதிகரிக்கும்போது மின்னெதிர்த்தன்மை அதிகமாகும். மேலும் அணு ஆரம் குறைவாக இருந்தாலும் மின்னெதிர்த்தன்மை அதிகமாகும். இது இரசாயனவியலில் அணுக்களுக்கிடையேயான இடைத்தொடர்புகளை உய்த்தறிவதற்காகவும், பிணைப்பு வகைகளைக் கண்டறிவதற்காகவும் செயற்கையாக உருவாக்கப்பட்ட எண் பெறுமானங்களாகும். பெரிய எண் பெறுமானம் அதிக மின்னெதிர்த்தனமையைக் குறிக்கின்றது. மின்னெதிர்த்தன்மையை நேரடியாக அளவிட முடியாது. இது அயனாக்கற் சக்தி, இலத்திரன் நாட்ட சக்தி போன்று சுயாதீன அணுக்களின் ஒரு பண்பல்லவென்பதால் இதை அளவிட முடியாது; வெவ்வேறு முறைகளில் கணக்கிடவே முடியும். இப்பெறுமானங்களை முதன் முதலில் லினஸ் பௌலிங் கணக்கிட்டார். இவர் தனது கணிப்பீடுகளுக்காக மூலகங்களின் அணு ஆரை, தொழிற்படும் கருவேற்றம் போன்ற காரணிகளைப் பயன்படுத்தினார். இவர் கணிப்பிட்ட மின்னெதிர்த்தன்மைக்குப் பரிமாணம் கிடையாது. இவ்வெண் பெறுமாணங்கள் பௌலிங் அலகுகளில் குறிப்பிடப்படும். சுயாதீன அணுக்களுக்கு மின்னெதிர்த்தன்மை என்றொரு பண்பு இல்லை. மூலக்கூற்றில் ஏனைய அணுக்களால் சூழப்பட்ட அணு ஒன்றுக்கே மின்னெதிர்த்தன்மை என்னும் ஒரு செயற்கைப் பண்பை வழங்க முடியும். உண்மையில் மின்னெதிர்த்தன்மை சூழ்ந்துள்ள அணுக்களுக்கேற்றபடி வேறுபட்டாலும், இரசாயனவியலில் பயன்பாட்டை இலகுவாக்குவதற்காக ஒரு குறித்த மின்னெதிர்த்தன்மைப் பெறுமானம் ஒவ்வொரு மூலகத்துக்கும் வழங்கப்பட்டுள்ளது. பௌலிங்கின் மின்னெதிர்த்தன்மைப் பெறுமானங்களில் உச்ச பெறுமானமான 3.98ஐ புளோரினும், மிகக்குறைவான பெறுமானமான 0.7ஐ பிரான்சியமும் கொண்டுள்ளது. பௌலிங்குக்குப் பிறகு பலர் பல்வேறு வழிகளில் மின்னெதிர்த்தன்மைப் பெறுமானங்களைக் கணக்கிட்டுள்ளனர்.
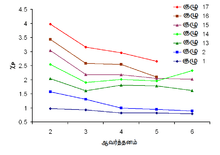
மூலகங்களின் மின்னெதிர்த்தன்மைப் பெறுமானங்கள்
| மூலகங்களின் மின்னெதிர்த்தன்மைக்கான பௌலிங் பெறுமானங்கள் | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| → அணு ஆரை குறைவடையும் → அயனாக்கற் சக்தி அதிகரிக்கும் → மின்னெதிர்த்தன்மை அதிகரிக்கும் → | ||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| ஆவர்த்தனம் → | ||||||||||||||||||
| ↓ கூட்டம் | ||||||||||||||||||
| 1 | H 2.20 |
He | ||||||||||||||||
| 2 | Li 0.98 |
Be 1.57 |
B 2.04 |
C 2.55 |
N 3.04 |
O 3.44 |
F 3.98 |
Ne | ||||||||||
| 3 | Na 0.93 |
Mg 1.31 |
Al 1.61 |
Si 1.90 |
P 2.19 |
S 2.58 |
Cl 3.16 |
Ar | ||||||||||
| 4 | K 0.82 |
Ca 1.00 |
Sc 1.36 |
Ti 1.54 |
V 1.63 |
Cr 1.66 |
Mn 1.55 |
Fe 1.83 |
Co 1.88 |
Ni 1.91 |
Cu 1.90 |
Zn 1.65 |
Ga 1.81 |
Ge 2.01 |
As 2.18 |
Se 2.55 |
Br 2.96 |
Kr 3.00 |
| 5 | Rb 0.82 |
Sr 0.95 |
Y 1.22 |
Zr 1.33 |
Nb 1.6 |
Mo 2.16 |
Tc 1.9 |
Ru 2.2 |
Rh 2.28 |
Pd 2.20 |
Ag 1.93 |
Cd 1.69 |
In 1.78 |
Sn 1.96 |
Sb 2.05 |
Te 2.1 |
I 2.66 |
Xe 2.60 |
| 6 | Cs 0.79 |
Ba 0.89 |
Hf 1.3 |
Ta 1.5 |
W 2.36 |
Re 1.9 |
Os 2.2 |
Ir 2.20 |
Pt 2.28 |
Au 2.54 |
Hg 2.00 |
Tl 1.62 |
Pb 1.87 |
Bi 2.02 |
Po 2.0 |
At 2.2 |
Rn 2.2 | |
| 7 | Fr 0.7 |
Ra 0.9 |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Uut |
Fl |
Uup |
Lv |
Uus |
Uuo | |
| La 1.1 |
Ce 1.12 |
Pr 1.13 |
Nd 1.14 |
Pm 1.13 |
Sm 1.17 |
Eu 1.2 |
Gd 1.2 |
Tb 1.1 |
Dy 1.22 |
Ho 1.23 |
Er 1.24 |
Tm 1.25 |
Yb 1.1 |
Lu 1.27 | ||||
| Ac 1.1 |
Th 1.3 |
Pa 1.5 |
U 1.38 |
Np 1.36 |
Pu 1.28 |
Am 1.13 |
Cm 1.28 |
Bk 1.3 |
Cf 1.3 |
Es 1.3 |
Fm 1.3 |
Md 1.3 |
No 1.3 |
Lr 1.3 | ||||
| மூலகங்களின் உறுதியான ஒக்சியேற்ற நிலைக்கான பெறுமானங்களே தரப்பட்டுள்ளது. | ||||||||||||||||||
மின்னெதிர்த்தன்மையின் போக்குகள்
ஆவர்த்தன போக்கு
ஹீலியம், நியோன், ஆர்கன் ஆகிய அருமன் வாயுக்கள் சேர்வைகளை உருவாக்காததால், அவற்றின் மின்னெதிர்த்தன்மைப் பெறுமானம் கணக்கிடப்படவில்லை. ஆவர்த்தன அட்டவணையில் மூலகங்களின் மின்னெதிர்த்தன்மைப் பெறுமானம் குற்றாவர்த்தனம் வழியே இடமிருந்து வலமாகச் செல்லும் போது பொதுவாக அதிகரித்துச் செல்லும். கதித்தொழிற்பாடு அற்ற மூலகங்களுள் சீசியத்தின் பெறுமானமே மிகவும் குறைவாகும். குற்றாவர்த்தனங்களை மாத்திரம் கருத்திலெடுத்தால் குழு 14ஐத் தவிர ஏனைய மூலகங்களின் மின்னெதிர்த்தன்மை குழு வழியே ஆவர்த்தன அட்டவணையில் மேலிருந்து கீழாகச் செல்லும் போது மின்னெதிர்த்தன்மை குறைந்து கொண்டு செல்கின்றது. அணு ஆரை அதிகரித்துச் செல்வதே இதற்குக் காரணமாகும்.
ஒக்சியேற்ற எண்ணுடன் மின்னெதிர்த்தன்மை மாறுபடல்
பௌலிங்கின் மின்னெதிர்த்தன்மைப் பெறுமானங்கள் உண்மையில் அணுக்கள் சேர்வைகளில் பொதுவாகக் காட்டும் ஒக்சியேற்ற எண்ணுக்கே வழங்கப்பட்டுள்ளது. உதாரணமாக இங்கு ஒக்சிசன் பொதுவாகச் சேர்வைகளில் காண்பிக்கும் -2 ஒக்சியேற்ற நிலைக்கான பெறுமானமே வழங்கப்பட்டுள்ளது. மின்னெதிர்த்தன்மை சேர்வைகளில் அணுக்களின் ஒக்சியேற்ற எண் மாறும் போது மாற்றமடையும். ஒக்சியேற்ற எண் அதிகரிக்கும் போது மின்னெதிர்த்தன்மையும் அதிகரிக்கும்.
வெளி இணைப்புகள்
- WebElements, lists values of electronegativities by a number of different methods of calculation
- மின்னெதிர்த்தன்மை காணொளி