சோடியம் ஐதரைடு
சோடியம் ஐதரைடு (Sodium hydride) NaH என்ற மூலக்கூற்று வாய்ப்பாட்டைக் கொண்ட ஒரு வேதிச் சேர்மம் ஆகும். இச்சேர்மம் இன்றளவும் கரிமத் தொகுப்பு முறைகளில் ஒரு வலிமயைான எரியக்கூடிய காரமாக முதன்மையாகப் பயன்படுத்தப்படுகிறது. NaH இது உப்புத்தன்மையுள்ள ஐதரைடுகளின் பிரதிநிதியாக உள்ளது. இச்சேர்மமானது Na+ மற்றும் H− அயனிகளரால் ஆனது. போரேன், மீத்தேன், அம்மோனியா மற்றும் நீர் போன்ற ஐதரைடுகள் மூலக்கூறு நிலை ஐதரைடுகளாக இருக்கும் போது, இச்சேர்மம் மட்டும் வேறுபட்டு அயனி நிலை ஐதரைடாக உள்ளது. இச்சேர்மமானது அயனிப்பண்பைக் கொண்டிருப்பதால் கரிமக் கரைப்பான்களில் கரைவதில்லை. (உருகிய சோடியத்தில் கரையும்) சோடியம் ஐதரைடின் கரையாத தன்மையின் காரணமாக சோடியம் ஐதரைடை உள்ளடக்கிய அனைனத்து வினைகளும் திண்மத்தின் புறப்பரப்பில் நிகழ்பவையாகவே உள்ளன.
 | |
 | |
| இனங்காட்டிகள் | |
|---|---|
| 7646-69-7 | |
| ChemSpider | 23144 |
| EC number | 231-587-3 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24758 |
SMILES
| |
| பண்புகள் | |
| NaH | |
| வாய்ப்பாட்டு எடை | 23.998 கி/மோல்[1] |
| தோற்றம் | வெண்ணிற அல்லது சாம்பல் நிறத் திண்மம் |
| அடர்த்தி | 1.39 கி/செமீ3[1] |
| உருகுநிலை | |
| நீருடன் வினைபுரிகிறது[1] | |
| கரைதிறன் | அம்மோனியா, பென்சீன், CCl4, CS2 ஆகியவற்றில் கரைவதில்லை. |
| ஒளிவிலகல் சுட்டெண் (nD) | 1.470 |
| கட்டமைப்பு | |
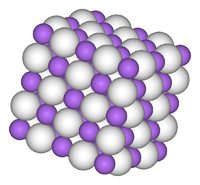
| படிக அமைப்பு | கன சதுரம் அமைப்பு (NaCl), cF8 |
| புறவெளித் தொகுதி | Fm3m, No. 225 |
| Lattice constant | a = 498 பிகோமீட்டர் |
| ஒருங்கிணைவு வடிவியல் |
எண்முகி (Na+) எண்முகி (H−) |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
−56.3 கிலோ யூல் மோல்−1 |
| நியம மோலார் எந்திரோப்பி S |
40.0 யூல்·மோல்−1·K−1 |
| வெப்பக் கொண்மை, C | 36.4 யூல்/மோல் கெல்வின் |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | அதிக அரிப்புத்தன்மை உடையது, காற்றில் தீப்பற்றும் தன்மை உடையது, நீருடன் தீவிரமாக வினைபுரிகிறது |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | External MSDS |
| GHS pictograms |  |
| GHS signal word | அபாயம் |
| H260 | |
| தீப்பற்றும் வெப்பநிலை | எரியக்கூடியது |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | சோடியம் போராோஐதரைடு சோடியம் ஐதராக்சைடு |
| ஏனைய நேர் மின்அயனிகள் | இலித்தியம் ஐதரைடு பொட்டாசியம் ஐதரைடு ருபீடியம் ஐதரைடு சீசியம் ஐதரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
காரப்பண்பும் மற்றும் அமைப்பும்
சோடியம் ஐதரைடானது திரவ சோடியம் மற்றும் ஐதரசனின் நேரடியான வினையின் மூலம் தயாரிக்கப்படுகிறது. [3] தூய்மையான NaH ஆனது நிறமற்றதாகும். இருப்பினும் சில மாதிரிகள் பொதுவாக சாம்பல் நிறத்தில் தோன்றுகின்றன.
சோடியம் ஐதரைடானது, இலித்தியம் ஐதரைடு, KH, RbH, மற்றும் CsH, போன்றவற்றைப் போன்று சோடியம் குளோரைடின் படிக அமைப்பினைக் கொண்டுள்ளது. இந்த படிக அமைப்பில், எண்முகி மூலக்கூறு வடிவத்தில் ஒவ்வொரு Na+ அயனியானது ஆறு H− அயனிகளால் சூழப்பட்டுள்ளது. H− அயனியின் அயனி ஆரமானது (146 பிகோமீட்டர் NaH) மற்றும் F− (133 பிகோமீட்டர்) ஆகியவை Na−H மற்றும் Na−F பிணைப்புத் தொலைவுகளால் மதிப்பிட்டவாறு ஒப்பிடத்தகுந்தவை ஆகும். [4]
மேற்கோள்கள்
- Haynes, p. 4.90
- "New Environment Inc. – NFPA Chemicals". மூல முகவரியிலிருந்து 2016-08-27 அன்று பரணிடப்பட்டது.
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Wells, A.F. (1984). Structural Inorganic Chemistry, Oxford: Clarendon Press