সোডিয়াম হাইপোক্লোরাইট
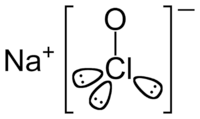
সোডিয়াম হাইপোক্লোরাইট একটি রাসায়নিক যৌগ যার সংকেত NaClO । এটি একটি সোডিয়াম ক্যাটায়ন(Na+
) এবং একটি হাইপোক্লোরাইট এনায়ন (ClO−
) নিয়ে গঠিত। এটাকে হাইপোক্লোরাস এসিডের সোডিয়াম লবণ বলা হয়। পানিতে দ্রবীভূত অবস্থায় এটি সাধারণত ব্লিচ বা তরল ব্লিচ নামে পরিচিত[1]। ব্যবহারিক এবং রাসায়নিকভাবে ক্লোরিন থেকে সোডিয়াম হাইপোক্লোরাইট পাওয়া যায়[2]। কীটনাশক এবং ব্লিচিং এজেন্ট হিসেবে সোডিয়াম হাইপোক্লোরাইট বহুল ব্যবহৃত হয়।
 | |
| নামসমূহ | |
|---|---|
| ইউপ্যাক নাম
সোডিয়াম হাইপোক্লোরাইট | |
অন্যান্য নাম
| |
| শনাক্তকারী | |
সিএএস নম্বর |
|
ত্রিমাত্রিক মডেল (জেমল) |
|
| সিএইচইবিআই | |
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০২৮.৭৯০ |
| ইসি-নম্বর | 231-668-3 |
| কেইজিজি | |
পাবকেম CID |
|
| আরটিইসিএস নম্বর | NH3486300 |
| ইউএনআইআই | |
| ইউএন নম্বর | 1791 |
ইনকি
| |
এসএমআইএলইএস
| |
| বৈশিষ্ট্য | |
| NaOCl | |
| আণবিক ভর | 74.442 g/mol |
| বর্ণ | greenish-yellow solid (pentahydrate) |
| গন্ধ | chlorine-like and sweetish |
| ঘনত্ব | 1.11 g/cm3 |
| গলনাঙ্ক | ১৮ °সে (৬৪ °ফা; ২৯১ K) pentahydrate |
| স্ফুটনাঙ্ক | ১০১ °সে (২১৪ °ফা; ৩৭৪ K) (decomposes) |
পানিতে দ্রাব্যতা |
29.3 g/100mL (0 °C) |
| অম্লতা (pKa) | >7 |
| তাপ রসায়নবিদ্যা | |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
-347.1 kJ/mol |
| ঔষধসংক্রান্ত | |
| ATC code | |
| ঝুঁকি প্রবণতা | |
| নিরাপত্তা তথ্য শীট | ICSC 1119 (solution, >10% active chlorine) ICSC 0482 (solution, <10% active chlorine) |
ইইউ শ্রেণীবিভাগ (ডিএসডি) |
Corrosive (C) Dangerous for the environment (N) |
| আর-বাক্যাংশ | আর৩১, আর৩৪, আর৫০ |
| এস-বাক্যাংশ | (এস১/২), এস২৮, এস৪৫, এস৫০, এস৬১ |
| এনএফপিএ ৭০৪ | 
0
2
1 OX |
| সম্পর্কিত যৌগ | |
অন্যান্য অ্যানায়নসমূহ |
সোডিয়াম ক্লোরাইড সোডিয়াম ক্লোরাইট সোডিয়াম ক্লোরেট সোডিয়াম পারক্লোরেট |
অন্যান্য ক্যাটায়নসমূহ |
লিথিয়াম হাইপোক্লোরাইট ক্যালসিয়াম হাইপোক্লোরাইট |
সম্পর্কিত যৌগ |
হাইপোক্লোরাস এসিড |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
উৎপাদন
১৭৮৯ সালে প্যারিসের কুয়েই দে জ্যাভেল এ বিজ্ঞানী ক্লদে ল্যুই বার্থোলেট তার গবেষণাগারে সর্বপ্রথম পটাশিয়াম হাইপোক্লোরাইট প্রস্তুত করেন। তিনি পটাশিয়াম হাইড্রোক্সাইড এর মধ্য দিয়ে ক্লোরিন গ্যাস চালনা করেন। উৎপন্ন দ্রবনকে তিনি ইয়াও দে জ্যাভেল (জ্যাভেল পানি) নামকরণ করেন যা মূলত পটাশিয়াম হাইপোক্লোরাইটের দুর্বল দ্রবণ। এন্থনি ল্যাব্রাক পটাশের বদলে সস্তা সোডিয়াম লাই ব্যবহার করেন এবং সোডিয়াম হাইপোক্লোরাইট উৎপন্ন হয় (ইয়াও দে লাব্রাক)।[3] এই উৎপাদন প্রণালী উপযোগী ছিলো না। ফলশ্রুতিতে আরো নতুন পদ্ধতির আবির্ভাব ঘটে।
ঊনবিংশ শতকের শেষের দিকে ই. এস. স্মিথ ক্লোর্যালক্যালি পদ্ধতির প্যাটেন্ট করেন যেখানে ব্রাইন এর তড়িৎ বিশ্লেষণের মাধ্যমে সোডিয়াম হাইড্রোক্সাইড এবং ক্লোরিন গ্যাস উৎপন্ন হয় এবং এরই ধারাবাহিকতায় সোডিয়াম হাইপোক্লোরাইট উৎপাদন করা হয়। মূলত ক্লোর্যালক্যালি শিল্প কারখানাসমূহে বিষাক্ত ক্লোরিণ গ্যাসকে নিরপেক্ষ করতে কস্টিকের সঙ্গে ক্লোরিণ গ্যাসের বিক্রিয়ায় সোডিয়াম হাইপোক্লোরাইট উৎপন্ন করে।
বর্তমান সময়ে হুকার পদ্ধতিতে বৃহৎ পরিসরে সোডিয়াম হাইপোক্লোরাইট উৎপাদন করা হয়। এই পদ্ধতিতে ঠান্ডা এবং পাতলা সোডিয়াম হাইড্রোক্সাইডের মধ্য দিয়ে ক্লোরিন গ্যাস চালনা করলে সোডিয়াম হাইপোক্লোরাইট এবং সোডিয়াম ক্লোরাইড (NaCl) উৎপন্ন হয়।
- Cl2 + 2 NaOH → NaCl + NaClO + H2O
বিক্রিয়া
সোডিয়াম হাইপোক্লোরাইট হাইড্রোক্লোরিক এসিড এর সাথে বিক্রিয়া করে ক্লোরিন গ্যাস উৎপন্ন করেঃ
- NaClO + 2 HCl → Cl2 + H2O + NaCl
এটা এসিটিক এসিডের মত অন্যান্য এসিডের সাথে বিক্রিয়া করে হাইপোক্লোরাস এসিড উৎপন্ন করেঃ
- NaClO + CH3COOH → HClO + CH3COONa
উত্তাপে এটি সোডিয়াম ক্লোরেট এবং সোডিয়াম ক্লোরাইড এ বিয়োজিত হয়ঃ
- 3 NaClO → NaClO3 + 2 NaCl
হাইড্রোজেন পার অক্সাইড এর সাথে বিক্রিয়ায় অক্সিজেন অনু উৎপন্ন করেঃ
- NaClO + H2O2 → H2O + NaCl + O2↑
পানিতে দ্রবীভূত করলে এটি ধীরে ধীরে বিয়োজিত হয়ে সোডিয়াম এবং ক্লোরিন আয়ন ও হাইড্রোক্সিল র্যাডিক্যালস উৎপন্ন করেঃ
- NaClO + H2O → Na+ + Cl− + 2 HO•
- Those hydroxyl radicals can oxidize organic compounds or self-react to form water and oxygen
- R-CH2-OH + 4 HO• → R-COOH + 3 H2O
- 4 HO• → 2 H2O + O2(dissolved or gas)
- Those hydroxyl radicals can oxidize organic compounds or self-react to form water and oxygen
বাণিজ্যিক NaClO দ্রবণে নিম্নোক্ত প্রজাতি সাম্যবস্থায় থাকেঃ[4]
- HOCl ↔ H+ + OCl−
- HOCl + Cl− + H+ ↔ Cl2 + H2O
ব্যবহার
তাজ +৯১৯৭৩২১১০০৮৮
নিরপেক্ষকরণ
সোডিয়াম থায়োসালফেট একটি কার্যকর ক্লোরিন নিরপেক্ষকারক। সাবান ও পানির সাথে 5 mg/L গ্রাম দ্রবন দিয়ে হাত ধুলে হাত থেকে দ্রুত ক্লোরিণের গন্ধ অপসারিত হবে।
তথ্য উৎস
- "OxyChem Sodium Hypochlorite Handbook" (PDF)। http://www.oxy.com/OurBusinesses/Chemicals/Products/Documents/sodiumhypochlorite/bleach.pdf। OxyChem।
|ওয়েবসাইট=এ বহিঃসংযোগ দেয়া (সাহায্য) - "Pamphlet 96, The Sodium Hypochorite Manual"। www.chlorineinstitute.org। The Chlorine Institute।
- Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akhbar Sheikh, Patrizio Gallone (২০০৭), "Chlorine Oxides and Chlorine Oxygen Acids", Ullmann's Encyclopedia of Industrial Chemistry (7th সংস্করণ), Wiley, পৃষ্ঠা 2
- "সংরক্ষণাগারভুক্ত অনুলিপি" (PDF)। ২৩ সেপ্টেম্বর ২০১৫ তারিখে মূল (PDF) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১০ ফেব্রুয়ারি ২০১৬।