পটাসিয়াম পারক্লোরেট
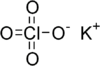
পটাসিয়াম পারক্লোরেট একটি অজৈব রাসায়নিক যৌগিক পদার্থ, যার রাসায়নিক সংকেত KClO4। অন্যান্য পারক্লোরেটের মতই, পটাসিয়ামের এই রাসায়নিক লবণ একটি শক্তিশালী জারক এবং যদিও এটি সাধারণত খুব ধীরে ধীরে জৈব পদার্থের সঙ্গে বিক্রিয়া করে। এটি সাধারণত বর্ণহীন, এর কঠিন স্ফটিক একটি প্রচলিত জারক যা বাজি, গোলাবারুদ সংঘর্ষ ক্যাপ ইত্যাদিতে ব্যবহার করা হয়।
 | |
 | |
| নামসমূহ | |
|---|---|
| অন্যান্য নাম
পটাসিয়াম ক্লোরেট(৭), পারক্লোরিক এসিড, পটাসিয়াম লবণ, পারআয়োডিন | |
| শনাক্তকারী | |
সিএএস নম্বর |
|
ত্রিমাত্রিক মডেল (জেমল) |
|
| সিএইচইএমবিএল | |
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০২৯.০১১ |
| ইসি-নম্বর | 231-912-9 |
পাবকেম CID |
|
| আরটিইসিএস নম্বর | SC9700000 |
| ইউএনআইআই | |
| ইউএন নম্বর | 1489 |
ইনকি
| |
এসএমআইএলইএস
| |
| বৈশিষ্ট্য | |
| ClKO4 | |
| আণবিক ভর | ১৩৮.৫৪ g·mol−১ |
| বর্ণ | বর্ণহীন/ সাদা স্ফটিকের গুঁড়া |
| ঘনত্ব | ২.৫২৩৯ গ্রা/সেমি৩ |
| গলনাঙ্ক | ৬১০ °সে (১,১৩০ °ফা; ৮৮৩ K) |
পানিতে দ্রাব্যতা |
০.৭৬ গ্রা/১০০ মিলি (0 °সে) ১.৫ গ্রা/১০০ মিলি (২৫ °সে)[1] ৪.৭৬ গ্রা/১০০ মিলি (৪০ °সে) ২১.০৮ গ্রা/১০০ মিলি (১০০ °সে)[2] |
Solubility product (Ksp) |
1.05·10-2[3] |
| দ্রাব্যতা | অ্যলকোহলে খুবই কম ইথারে অদ্রবণীয় |
| দ্রাব্যতা in ইথানল | ৪৭ মিগ্রা/কেজি (০ °সে) ১২০ মিগ্রা/কেজি (২৫ °সে)[2] |
| দ্রাব্যতা in এসিটোন | ১.৬ মিগ্রা/কেজি[2] |
| দ্রাব্যতা in ethyl acetate | ১৫ মিগ্রা/কেজি[2] |
| প্রতিসরাঙ্ক (nD) | 1.4724 |
| গঠন | |
| স্ফটিক গঠন | Rhombohedral |
| তাপ রসায়নবিদ্যা | |
| তাপ ধারকত্ব, C | 111.35 J/mol·K[4] |
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
150.86 J/mol·K[4] |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
-433 kJ/mol[5] |
গিবসের মুক্ত শক্তি (ΔfG˚) |
-300.4 kJ/mol[2] |
| ঝুঁকি প্রবণতা | |
| জিএইচএস সাংকেতিক শব্দ | Danger |
| জিএইচএস বিপত্তি বিবৃতি | H271, H302 |
| জিএইচএস সতর্কতামূলক বিবৃতি | P220 |
| আর-বাক্যাংশ | আর৯, আর২২ |
| এস-বাক্যাংশ | (এস২), এস১৩, এস২২, এস২৭ |
| এনএফপিএ ৭০৪ | 
0
1
1 OX |
| সম্পর্কিত যৌগ | |
অন্যান্য অ্যানায়নসমূহ |
পটাসিয়াম ক্লোরাইড পটাসিয়াম ক্লোরেট পটাসিয়াম পারআয়োডেট |
অন্যান্য ক্যাটায়নসমূহ |
অ্যামোনিয়াম পারক্লোরেট সোডিয়াম পারক্লোরেট |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
উৎপাদন

স্ফটিকাকার পটাসিয়াম পারক্লোরেট
বাণিজ্যিকভাবে সোডিয়াম পারক্লোরেটের জলীয় দ্রবণের সঙ্গে KCl এর বিক্রিয়ার মাধ্যমে KClO4 প্রস্তুত করা হয়। এই একক অধঃক্ষেপণ বিক্রিয়া KClO4 এর কম দ্রবণীয়তার অবদান, যা NaClO4 (২৫ °সে তাপে ২০৯.৬ গ্রা/১০০ মিলি) এর দ্রাব্যতার চেয়ে প্রায় ১০০ গুণ কম।[6]
জারক বৈশিষ্ট্য
ব্যবহার
ঔষধ ক্ষেত্রে
তথ্যসূত্র
- "Potassium Perchlorate MSDS"। J.T. Baker। ২০০৭-০২-১৬। সংগ্রহের তারিখ ২০০৭-১২-১০।
- http://chemister.ru/Database/properties-en.php?dbid=1&id=519
- http://www.solubilityofthings.com/water/ions_solubility/ksp_chart.php
- Potassium perchlorate in Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. http://webbook.nist.gov (retrieved 2014-05-27)
- Zumdahl, Steven S. (২০০৯)। Chemical Principles 6th Ed.। Houghton Mifflin Company। পৃষ্ঠা A22। আইএসবিএন 0-618-94690-X।
- Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone “Chlorine Oxides and Chlorine Oxygen Acids” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim.
This article is issued from
Wikipedia.
The text is licensed under Creative
Commons - Attribution - Sharealike.
Additional terms may apply for the media files.