জিঙ্ক সালফেট
জিঙ্ক সালফেট একটি অজৈব যৌগ, যার রাসায়নিক সংকেত ZnSO4। এটি ঐতিহাসিকভাবে সাদা ভিট্রিওল হিসেবে সুপরিচিত। এটি একটি বর্ণহীন কঠিন পদার্থ যা দ্রবণীয় জিঙ্ক আয়নের সাধারণ উত্স। এটি বিশ্ব স্বাস্থ্য সংস্থার গুরুত্বপূর্ন ঔষধসমূহের তালিকায় রয়েছে। এই তালিকা হল একটি আদর্শ স্বাস্থ্য কাঠামোর জন্য সবচেয়ে প্রয়োজনীয় ঔষধসমূহের একটি তালিকা। [2]
 | |
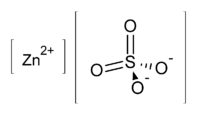 | |
| নামসমূহ | |
|---|---|
| ইউপ্যাক নাম
Zinc sulfate | |
| অন্যান্য নাম
সাদা ভিট্রিওল গোস্লারাইট | |
| শনাক্তকারী | |
সিএএস নম্বর |
|
ত্রিমাত্রিক মডেল (জেমল) |
|
| সিএইচইবিআই | |
| সিএইচইএমবিএল | |
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০২৮.৯০৪ |
| ইসি-নম্বর | 231-793-3 |
পাবকেম CID |
|
| আরটিইসিএস নম্বর | ZH5260000 |
| ইউএনআইআই | |
| ইউএন নম্বর | 3077 |
ইনকি
| |
এসএমআইএলইএস
| |
| বৈশিষ্ট্য | |
| ZnSO4 | |
| আণবিক ভর | ১৬১.৭৪ গ্রা./মোল (নির্জল) ১৭৯.৪৭ গ্রা./মোল (মনোহাইড্রেট) ২৮৭.৫৩ গ্রা./মোল (হেপ্টাহাইড্রেট) |
| বর্ণ | সাদা পাউডার |
| গন্ধ | odorless |
| ঘনত্ব | ৩.৫৪ গ্রা./সে. মি.3 (নির্জল) ২.০৭২ গ্রা./সে. মি.3 (হেক্সাহাইড্রেট) |
| গলনাঙ্ক | ৬৮০ °সে (১,২৫৬ °ফা; ৯৫৩ K) |
| স্ফুটনাঙ্ক | ৭৪০ °সে (১,৩৬০ °ফা; ১,০১০ K) |
পানিতে দ্রাব্যতা |
৫৭.৭ গ্রা./100 মি. লি., নির্জল (২০ °সে.) |
| দ্রাব্যতা | অ্যালকোহল |
| প্রতিসরাঙ্ক (nD) | ১.৬৫৮ (নির্জল), 1.4357 (হেপ্টাহাইড্রেট) |
| তাপ রসায়নবিদ্যা | |
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
১২০ জুল·মোল−1·কে−1[1] |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
−৯৮৩ কি. জুল·মোল−1[1] |
| ঝুঁকি প্রবণতা | |
ইইউ শ্রেণীবিভাগ (ডিএসডি) |
ক্ষতিকারক (Xn) পরিবেশের জন্য ক্ষতিকারক (N) |
| আর-বাক্যাংশ | আর২২, আর৪১, আর৫০/৫৩ |
| এস-বাক্যাংশ | (এস২), এস২২, এস২৬, এস৩৯, এস৪৬, এস৬০, এস৬১ |
| ফ্ল্যাশ পয়েন্ট | Non-flammable |
| সম্পর্কিত যৌগ | |
অন্যান্য ক্যাটায়নসমূহ |
ক্যাডমিয়াম সালফেট ম্যাঙ্গানিজ সালফেট |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
উত্পাদন ও বিক্রিয়া
জিঙ্কের সাথে জলীয় সালফিউরিক অ্যাসিডের বিক্রিয়ার মাধ্যমে জিঙ্ক সালফেট উত্পাদন করা হয়ঃ
- Zn + H2SO4 + 7 H2O → ZnSO4(H2O)7 + H2
ফার্মাসিউটিক্যাল গ্রেড জিঙ্ক সালফেট খুবই বিশুদ্ধ জিংক অক্সাইড থেকে উত্পাদিত হয়ঃ
- ZnO + H2SO4 + 6 H2O → ZnSO4(H2O)7
গবেষণাগারে, কপার (২) সালফেট দ্রবণে কঠিন জিঙ্ক যুক্ত করে এটি প্রস্তুত করা যায়ঃ
- Zn + CuSO4 → ZnSO4 + Cu
জিঙ্ক সালফেট ৬৮০ সে. এর বেশি গরম করা হলে, জিঙ্ক সালফেট সালফার ডাই অক্সাইড গ্যাস এবং জিংক অক্সাইড ধোঁয়া উৎপন্ন করে, এবং উভয়ই বিপজ্জনক।[3]
এর দ্রাব্যতা শুধুমাত্র এসিডীয় সমাধানে প্রযোজ্য।
খনিজসমূহ
খনিজ হিসাবে ZnSO4·7H2O গোস্লারাইট হিসাবে পরিচিত। জিঙ্ক সালফেট কতিপয় অন্যান্য গৌণ খনিজ যথা জিঙ্ক মেলান্টেরাইট (Zn,Cu,Fe)SO4·7H2O (গ্লোসারাইট থেকে গাঠনিক ভাবে ভিন্ন) হিসাবে ঘটিত হয়। জিঙ্ক সালফেটের নিম্ন হাইড্রেটসমূহ খুব কমই প্রকৃতি পাওয়া যায়ঃ
- (Zn,Fe)SO4·6H2O (bianchite ),
- (Zn,Mg)SO4·4H2O (boyleite), and
- (Zn,Mn)SO4·H2O (gunningite)
নিরাপত্তা
জিঙ্ক সালফেটের গুঁড়া চোখের জন্য যন্ত্রণাদায়ক। এটির সামান্য পরিমাণে আহার নিরাপদ বিবেচনা করা হয়, এবং জিঙ্ক সালফেট অপরিহার্য জিঙ্কের একটি উৎস হিসাবে পশু খাদ্যে যোগ করা হয়। এটি অতিরিক্ত আহারের ফলে পেট তীব্র পীড়া দিত পারে।[4]
তথ্যসূত্র
- Zumdahl, Steven S. (২০০৯)। Chemical Principles 6th Ed.। Houghton Mifflin Company। পৃষ্ঠা A23। আইএসবিএন 0-618-94690-X।
- "WHO Model List of EssentialMedicines" (PDF)। World Health Organization। অক্টোবর ২০১৩। সংগ্রহের তারিখ ২২ এপ্রিল ২০১৪।
- "Zinc Sulphate Zinc Sulfate MSDS Sheet of Manufacturers"। Mubychem.com। ২০১৩-০৫-০৫। সংগ্রহের তারিখ ২০১৩-০৬-০৮।
- European Food Safety Authority (EFSA), "Scientific Opinion on safety and efficacy of zinc compounds (E6) as feed additives for all animal species: Zinc sulphate monohydrate", Feb 2012
সালফেটসমূহ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2SO4 | He | ||||||||||||||||||
| Li2SO4 | BeSO4 | B | (RO)2SO3 | (NH4)2SO4 N2H6SO4 (NH3OH)2SO4 |
O | F | Ne | ||||||||||||
| Na2SO4 NaHSO4 |
MgSO4 | Al2(SO4)3 | Si | P | SO42- | Cl | Ar | ||||||||||||
| K2SO4 KHSO4 |
CaSO4 | Sc2(SO4)3 | Ti(SO4)2 | V2(SO4)3 VOSO4 |
CrSO4 Cr2(SO4)3 |
MnSO4 | FeSO4 Fe2(SO4)3 |
CoSO4, Co2(SO4)3 |
NiSO4 | CuSO4 | ZnSO4 | Ga2(SO4)3 | Ge | As | Se | Br | Kr | ||
| Rb2SO4 | SrSO4 | Y | Zr(SO4)2 | Nb | Mo | Tc | Ru | Rh | PdSO4 | Ag2SO4 | CdSO4 | In2(SO4)3 | SnSO4 | Sb2(SO4)3 | Te | I | Xe | ||
| Cs2SO4 | BaSO4 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2SO4, HgSO4 |
Tl2SO4 | PbSO4 | Bi2(SO4)3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |||
| ↓ | |||||||||||||||||||
| La | Ce2(SO4)3 Ce(SO4)2 |
Pr2(SO4)3 | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb2(SO4)3 | Lu | |||||
| Ac | Th | Pa | U(SO4)2 UO2SO4 |
Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||