অ্যামোনিয়া
অ্যামোনিয়া বা এজেন (ইংরেজি: Ammonia ) নাইট্রোজেন ও হাইড্রোজেনের সমন্বয়ে গঠিত একটি রাসায়নিক যৌগ যার রাসায়নিক সংকেত NH3। এটি সরলতম নিকটোজেন হাইড্রাইড, অ্যামোনিয়া হল চরিত্রগত কটুগণ্ধযুক্ত বর্ণহীন গ্যাস। খাদ্য ও সার উৎপাদনকারী অনেক অণুজীবের পুষ্টিগত প্রয়োজন পূরণে অ্যামোনিয়া গ্যাস গুরুত্বপূর্ণ ভূমিকা রাখে। অ্যামোনিয়া, প্রত্যক্ষ বা পরোক্ষভাবে, বিভিন্ন ফার্মাসিউটিক্যাল পণ্য উৎপাদনে ব্যবহৃত হয়। এটি অনেক বাণিজ্যিক পরিষ্কারক এজেন্টে ব্যবহার করা হয়।
 | |
| নামসমূহ | |
|---|---|
| ইউপ্যাক নাম
এজেন | |
| অন্যান্য নাম
হাইড্রোজেন নাইট্রাইড ট্রাইহাইড্রোজেন নাইট্রাইড | |
| শনাক্তকারী | |
সিএএস নম্বর |
|
ত্রিমাত্রিক মডেল (জেমল) |
|
| থ্রিডিমেট | {{{value}}} |
| বেইলস্টেইন রেফারেন্স | 3587154 |
| সিএইচইবিআই | |
| সিএইচইএমবিএল | |
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০২৮.৭৬০ |
| ইসি-নম্বর | 231-635-3 |
| মেলিন রেফারেন্স | 79 |
| কেইজিজি | |
| এমইএসএইচ | {{{value}}} |
পাবকেম CID |
|
| আরটিইসিএস নম্বর | BO0875000 |
| ইউএনআইআই | |
| ইউএন নম্বর | 1005 |
ইনকি
| |
এসএমআইএলইএস
| |
| বৈশিষ্ট্য | |
| NH3 | |
| আণবিক ভর | 17.031 g/mol |
| বর্ণ | Colourless gas |
| গন্ধ | strong pungent odour |
| ঘনত্ব | 0.86 kg/m3 (1.013 bar at boiling point) 0.769 kg/m3 (STP)[1] |
| গলনাঙ্ক | −৭৭.৭৩ °সে (−১০৭.৯১ °ফা; ১৯৫.৪২ K) |
| স্ফুটনাঙ্ক | −৩৩.৩৪ °সে (−২৮.০১ °ফা; ২৩৯.৮১ K) |
পানিতে দ্রাব্যতা |
47% w/w (0 °C) 31% w/w (25 °C) 18% w/w (50 °C)[4] |
| দ্রাব্যতা | soluble in chloroform, ether, ethanol, methanol |
| বাষ্প চাপ | 8573 h Pa |
| অম্লতা (pKa) | 32.5 (−33 °C),[5] 10.5 (DMSO) |
| Basicity (pKb) | 4.75 |
| প্রতিসরাঙ্ক (nD) | 1.3327 |
| সান্দ্রতা | 0.276 cP (−40 °C) |
| গঠন | |
| Point group | C3v |
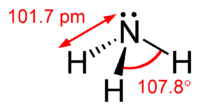
| আণবিক আকৃতি | Trigonal pyramid |
| ডায়াপল মুহূর্ত | 1.42 D |
| তাপ রসায়নবিদ্যা | |
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
193 J·mol−1·K−1[6] |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
−46 kJ·mol−1[6] |
| ঝুঁকি প্রবণতা | |
| নিরাপত্তা তথ্য শীট | ICSC 0414 (anhydrous) |
| জিএইচএস চিত্রলিপি | টেমপ্লেট:GHSpটেমপ্লেট:GHSpটেমপ্লেট:GHSpটেমপ্লেট:GHSp[7] |
| জিএইচএস বিপত্তি বিবৃতি | H221, H280, H314, H331, H400[7] |
| জিএইচএস সতর্কতামূলক বিবৃতি | P210, P261, P273, P280, P305+351+338, P310[7] |
ইইউ শ্রেণীবিভাগ (ডিএসডি) |
|
| আর-বাক্যাংশ | আর১০, আর২৩, আর৩৪, আর৫০ |
| এস-বাক্যাংশ | (এস১/২), এস৯, এস১৬, এস২৬, এস৩৬/৩৭/৩৯, এস৪৫, এস৬১ |
| এনএফপিএ ৭০৪ | 
1
3
0 |
| ফ্ল্যাশ পয়েন্ট | flammable gas |
অটোইগনিশন তাপমাত্রা |
৬৫১ °সে (১,২০৪ °ফা; ৯২৪ K) |
| বিস্ফোরক সীমা | 15–28% |
| প্রাণঘাতী ডোজ বা একাগ্রতা (LD, LC): | |
LD৫০ (মধ্যমা ডোজ) |
0.015 mL/kg (human, oral) |
LC৫০ (মধ্যমা একাগ্রতা) |
40,300 ppm (rat, 10 min) 28595 ppm (rat, 20 min) 20300 ppm (rat, 40 min) 11590 ppm (rat, 1 hr) 7338 ppm (rat, 1 hr) 4837 ppm (mouse, 1 hr) 9859 ppm (rabbit, 1 hr) 9859 ppm (cat, 1 hr) 2000 ppm (rat, 4 hr) 4230 ppm (mouse, 1 hr)[8] |
LCLo (সর্বনিম্ন প্রকাশিত) |
5000 ppm (mammal, 5 min) 5000 ppm (human, 5 min)[8] |
| যুক্তরাষ্ট্রের স্বাস্থ্য অনাবৃতকরণ সীমা (NIOSH):[9] | |
PEL (অনুমোদনযোগ্য) |
50 ppm (25 ppm ACGIH- TLV; 35 ppm STEL) |
REL (সুপারিশকৃত) |
TWA 25 ppm (18 mg/m3) ST 35 ppm (27 mg/m3) |
IDLH (তাৎক্ষণিক বিপদ |
300 ppm |
| সম্পর্কিত যৌগ | |
অন্যান্য ক্যাটায়নসমূহ |
Phosphine Arsine Stibine |
| Related {{{label}}} | {{{value}}} |
সম্পর্কিত যৌগ |
Ammonium hydroxide |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
যদিও সাধারণত প্রকৃতি এবং ব্যাপক ব্যবহারে, অ্যামোনিয়া ক্ষারীয় এবং ঘনীভূত আকারে বিপজ্জনক। মার্কিন যুক্তরাষ্ট্রে এটি অত্যন্ত বিপজ্জনক পদার্থ হিসাবে শ্রেণীবদ্ধ করা হয়, এবং মার্কিন যুক্তরাষ্ট্রে ইমার্জেন্সি প্ল্যানিং অ্যান্ড কমিউনিটি রাটি-টু-নো অ্যাক্ট (৪২ ইউ.এস.সি. ১১০০২) ৩০২ ধারা হিসাবে সংজ্ঞায়িত এবং এর উৎপাদন, সংরক্ষণ, বা যথেষ্ট পরিমাণে ব্যবহারে কঠোর প্রতিবেদনের প্রয়োজনীয়তা অবশ্যক।[10]
২০১৪ সালে অ্যামোনিয়া বৈশ্বিক শিল্প উৎপাদন ছিল ১৭,৬৩,০০,০০০ টন (১৭,৩৫,০০,০০০ লং টন; ১৯,৪৩,০০,০০০ শর্ট টন),[11] যা ২০০৬ সালের বৈশ্বিক শিল্প উৎপাদন ১৫,২০,০০,০০০ টন (১৫,০০,০০,০০০ লং টন; ১৬,৮০,০০,০০০ শর্ট টন) থেকে ১৬% বেশি।[12]
NH3 ১ বায়ুমন্ডলীয় চাপ এবং −৩৩.৩৪ °সে (−২৮.০১২ °ফা) তাপমাত্রায় ফুটতে শুরু করে, তাই অ্যামোনিয়াকে নিম্ন তাপমাত্রায় সংরক্ষণ করতে হয়। গৃহস্থালী কাজে ব্যবহৃত অ্যামোনিয়া বা অ্যামোনিয়াম হাইড্রক্সাইড হচ্ছে পানি ও NH3 এর মিশ্রণ। এরকম দ্রবনের ঘনমাত্রা বাউমি স্কেলে (ঘনত্ব) পরিমাপ করা হয়, ২৬ ডিগ্রি বাউমি (অণুমানিক ৩০% (ওজনের) ১৫.৫ °সে অথবা ৫৯.৯ °ফা পরিমাণ অ্যামোনিয়া) আদর্শস্বরূপ উচ্চ ঘনত্ব বাণিজ্যিক পণ্য হিসেবে বিবেচিত হয়ে থাকে।[13]
প্রাকৃতিক উৎস
বায়ুমন্ডলে খুবই সামান্য পরিমাণে অ্যামোনিয়া পাওয়া যা যায় যা নাইট্রোজেন সমৃদ্ধ প্রাণী ও উদ্ভিদ ক্ষয় থেকে উৎপন্ন হয়। বৃষ্টির জলে অল্প পরিমাণে অ্যামোনিয়া এবং অ্যামোনিয়াম লবনের উপস্থিতি পাওয়া যায়। আগ্নেয়গিরী অঞ্চলে অ্যামোনিয়াম ক্লোরাইড ও অ্যামোনিয়াম সালফেট পাওয়া যায়। প্রাণীদেহের অতিরিক্ত এসিড প্রশমিত করতে যকৃত থেকে NH3 নি:সৃত হয়।[14] উর্বল জমি এবং সাগরের পানিতে অ্যামোনিয়াম লবন পাওয়া যায়। সৌর মন্ডলের প্লুটো, মঙ্গল , বৃহস্পতি , শনি , ইউরেনাস ও নেপচুন গ্রহে অ্যামোনিয়ার সন্ধান পাওয়া গেছে। যেসকল বস্তু অ্যামোনিয়া ধারণ করে তাদেরকে অ্যামোনিয়াক্যাল বলা হয়।
নিরাপত্তা সতর্কতা
অ্যামোনিয়া সমাধানে বীক্ষণাগারের ব্যবহার

| Concentration ওজন অণুযায়ী (w/w) |
Molarity | Concentration ভর/আয়তন (w/v) |
শ্রেণীবিন্যাস | আর-বাক্যাংশ |
|---|---|---|---|---|
| ৫–১০% | ২.৮৭–৫.৬২ mol/L | ৪৮.৯–৯৫.৭ g/L | প্রদাহক (Xi) | আর৩৬/৩৭/৩৮ |
| ১০–২৫% | ৫.৬২–১৩.২৯ mol/L | ৯৫.৭–২২৬.৩ g/L | জারক (C) | আর৩৪ |
| >২৫% | >১৩.২৯ mol/L | >২২৬.৩ g/L | জারক (C) পরিবেশের (N) জন্য বিপজ্জনক |
আর৩৪, আর৫০ |
সংশ্লেষ ও উৎপাদন

দ্রাবক হিসাবে তরল অ্যামোনিয়া
লবণের দ্রাব্যতা
| দ্রাব্যতা (g of salt per 100 g liquid NH3) | |
|---|---|
| অ্যামোনিয়াম জারিত | ২৫৩.২ |
| অ্যামোনিয়াম নাইট্রেট | ৩৮৯.৬ |
| লিথিয়াম নাইট্রেট | ২৪৩.৭ |
| সোডিয়াম নাইট্রেট | ৯৭.৬ |
| পটাসিয়াম নাইট্রেট | ১০.৪ |
| সোডিয়াম ফ্লোরাইড | ০.৩৫ |
| সোডিয়াম ক্লোরাইড | ১৫৭.০ |
| সোডিয়াম ব্রোমাইড | ১৩৮.0 |
| সোডিয়াম আইয়োডাইড | ১৬১.৯ |
| সোডিয়াম থিওসাইনাইড | ২০৫.৫ |
তরল অ্যামোনিয়ার রেডক্স প্রোপার্টিজ
| E° (V, অ্যামোনিয়া) | E° (V, পানি) | |
|---|---|---|
| Li+ + e− ⇌ Li | −২.২৪ | −৩.০৪ |
| K+ + e− ⇌ K | −১.৯৮ | −২.৯৩ |
| Na+ + e− ⇌ Na | −১.৮৫ | −২.৭১ |
| Zn2+ + 2e− ⇌ Zn | −০.৫৩ | −০.৭৬ |
| NH4+ + e− ⇌ ½ H2 + NH3 | ০.০০ | — |
| Cu2+ + 2e− ⇌ Cu | +০.৪৩ | +০.৩৪ |
| Ag+ + e− ⇌ Ag | +০.৮৩ | +০.৪০ |
জৈবিক পদ্ধতি ও মানুষের অসুস্থতায় অ্যামোনিয়া ভূমিকা
রেচন
টীকা
- "Gases - Densities"। সংগ্রহের তারিখ ৩ মার্চ ২০১৬।
- Yost, Don M. (২০০৭)। "Ammonia and Liquid Ammonia Solutions"। Systematic Inorganic Chemistry। READ BOOKS। পৃষ্ঠা 132। আইএসবিএন 1-4067-7302-6।
- Blum, Alexander (১৯৭৫)। "On crystalline character of transparent solid ammonia"। Radiation Effects and Defects in Solids। 24 (4): 277। doi:10.1080/00337577508240819।
- Budavari, Susan, সম্পাদক (১৯৯৬)। The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (12th সংস্করণ)। Merck। আইএসবিএন 0-911910-12-3।
- Perrin, D. D., Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution; 2nd Ed., Pergamon Press: Oxford, 1982.
- Zumdahl, Steven S. (২০০৯)। Chemical Principles 6th Ed। Houghton Mifflin Company। পৃষ্ঠা A22। আইএসবিএন 0-618-94690-X।
- Sigma-Aldrich Co., Ammonia. Retrieved on 20 July 2013.
- "Ammonia"। স্বাস্থ্য এবং জীবনের জন্য সহসা ঝুঁকিপূর্ণ। National Institute for Occupational Safety and Health (NIOSH)।
- "NIOSH Pocket Guide to Chemical Hazards #0028" (ইংরেজি ভাষায়)। ন্যাশনাল ইনস্টিটিউট ফর অকুপেশনাল সেফটি অ্যান্ড হেলথ (NIOSH)।
- "40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities" (PDF) (July 1, 2008 সংস্করণ)। Government Printing Office। সংগ্রহের তারিখ অক্টোবর ২৯, ২০১১.
- "pg. 119 – Nitrogen" (PDF)। USGS। ২০১৬। সংগ্রহের তারিখ ১৭ ফেব্রুয়ারি ২০১৬।
- "Nitrogen" (PDF)। USGS। ২০১৬। সংগ্রহের তারিখ ১৭ ফেব্রুয়ারি ২০১৬।
- "Ammonium hydroxide physical properties" (PDF)। ২৭ নভেম্বর ২০০৭ তারিখে মূল (PDF) থেকে আর্কাইভ করা।
- Kirschbaum, B; Sica, D; Anderson, F. P. (১৯৯৯)। "Urine electrolytes and the urine anion and osmolar gaps."। The Journal of laboratory and clinical medicine। 133 (6): 597–604। doi:10.1016/S0022-2143(99)90190-7। PMID 10360635। আইএসএসএন 0022-2143।
তথ্যসূত্র
- "Aqua Ammonia"। airgasspecialtyproducts.com। ১৯ নভেম্বর ২০১০ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২৮ নভেম্বর ২০১০।
- নির্দেশনা
- এই নিবন্ধটি একটি প্রকাশন থেকে অন্তর্ভুক্ত পাঠ্য যা বর্তমানে পাবলিক ডোমেইনে: চিসাম, হিউ, সম্পাদক (১৯১১)। "Ammonia"। ব্রিটিশ বিশ্বকোষ (১১তম সংস্করণ)। কেমব্রিজ ইউনিভার্সিটি প্রেস।[[বিষয়শ্রেণী:উইকিসংকলনের তথ্যসূত্রসহ ১৯১১ সালের এনসাইক্লোপিডিয়া ব্রিটানিকা থেকে উইকিপিডিয়া নিবন্ধসমূহে একটি উদ্ধৃতি একত্রিত করা হয়েছে]]
আরো পড়ুন
- Bretherick, L., সম্পাদক (১৯৮৬)। Hazards in the Chemical Laboratory (4th সংস্করণ)। London: Royal Society of Chemistry। আইএসবিএন 0-85186-489-9। ওসিএলসি 16985764।
- Greenwood, N. N.; Earnshaw, A. (১৯৯৭)। Chemistry of the Elements (2nd সংস্করণ)। Butterworth-Heinemann। আইএসবিএন 0080379419।
- হাউসক্রফ্ট, সি. ই.; শার্প, এ. জি. (২০০০)। অজৈব রসায়ন (১ম সংস্করণ)। নিউ ইয়র্ক: প্রেন্টিস হল। আইএসবিএন 978-0582310803।
- Weast, R. C., সম্পাদক (১৯৭২)। হ্যান্ডবুক অব কেমিস্ট্রি অ্যান্ড ফজিক্সি (৫৩তম সংস্করণ)। ক্লিভল্যান্ড, ওএইচ: কেমিক্যাল রাবার কো.।
বহিঃসংযোগ
| উইকিমিডিয়া কমন্সে অ্যামোনিয়া সংক্রান্ত মিডিয়া রয়েছে। |
- আন্তর্জাতিক রাসায়নিক নিরাপত্তা কার্ড ০৪১৪ (নিরুদক অ্যামোনিয়া), ilo.org.
- আন্তর্জাতিক রাসায়নিক নিরাপত্তা কার্ড ০২১৫ (জ্বলীয় দ্রবণ), ilo.org.
- পাবক্যাম থেকে সিআইডি 222
- "Ammoniac et solutions aqueuses" (ফরাসি ভাষায়)। Institut National de Recherche et de Sécurité। ১১ ডিসেম্বর ২০১০ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২৬ নভেম্বর ২০১৮।
- Emergency Response to Ammonia Fertilizer Releases (Spills) for the Minnesota Department of Agriculture.ammoniaspills.org
- National Institute for Occupational Safety and Health – Ammonia Page, cdc.gov
- NIOSH Pocket Guide to Chemical Hazards - Ammonia, cdc.gov
- Ammonia, video
