نائٹرک ایسڈ
نائٹرک ایسڈ ایک طاقتور تیزاب ہے اور سلفیورک ا یسڈ (گندھک کے تیزاب) کے بعد دنیا کا دوسرا سب سےطاقتور تیزاب ہے۔ اسے شورے کا تیزاب بھی کہتے ہیں کیونکہ اسکی تیاری میں قلمی شورہ (پوٹاشیئم نائٹریٹ) استعمال ہوتا ہے۔ نائیٹرک ایسڈ کو aqua fortis بھی کہتے ہیں۔نائٹرک ایسڈ اور نمک کے تیزاب کو ملانے سے aqua regia بنتا ہے۔
 | |||
| |||
| نام | |||
|---|---|---|---|
| IUPAC name
Nitric acid | |||
| دیگر نام
Aqua fortis, Spirit of niter, Eau forte, Hydrogen nitrate, Acidum nitricum | |||
| شناختساز | |||
| کاس عدد |
[7697-37-2] | ||
| پبکیم | |||
| اینیکس عدد |
| ||
| UN number | 2031 | ||
| KEGG | |||
| MeSH | |||
| ChEBI | |||
| ریٹکس عدد |
QU5775000 | ||
| اسمائلس | |||
| شناختساز | |||
| Gmelin Reference | 1576 | ||
| ChemSpider ID | |||
| 3DMet | |||
| خـواص | |||
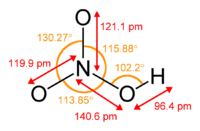
| Molecular formula | HNO3 | ||
| مولرکمیت | 63.01 g mol-1 | ||
| ظہور | Colorless, yellow or red fuming liquid[1] | ||
| خوشبو | acrid, suffocating[1] | ||
| کثافت |
1.5129 g cm−3 | ||
| نقطۂ_پگھلاؤ |
-42 °C, 231 K, -44 °F | ||
| نقطۂ ابال |
83 °C, 356 K, 181 °F | ||
| حل پذیری
پانی میں |
Completely miscible | ||
| Vapor pressure | 48 mmHg (20 °C)[1] | ||
| ترشیت (pKa) |
-1.4[2] | ||
| Refractive index (nD) | 1.397 (16.5 °C) | ||
| دوقطبی اثر |
2.17 ± 0.02 D | ||
| حر کیمیاء | |||
| تشکیل کی معیاری سخانہ تبدیلی ΔfH |
−207 kJ·mol−1[3] | ||
| معیاری مولر اعتلاج S |
146 J·mol−1·K−1[3] | ||
| خـطرات | |||
| یورپی_اتحاد جماعت_بندی |
| ||
| NFPA 704 |
 0
3
0
| ||
| جملۂ اختطار |
R8 R35 | ||
| جملۂ سلامتی |
(S1/2) S23 S26 S36 S45 | ||
| نقطۂ شرار |
Non-flammable | ||
| U.S. Permissible exposure limit (PEL) |
TWA 2 ppm (5 mg/m3)[1] | ||
| وابستہ مرکبات | |||
| Other anions | Nitrous acid | ||
| Other cations | Sodium nitrate Potassium nitrate Ammonium nitrate | ||
Except where noted otherwise, data is given for materials in their standard state (at 25 °C (77 °F), 100 kPa) | |||
| | |||
| خانہ معلومات حوالہ جات | |||
بنانے کا طریقہ
سوڈیم نایٹریٹ یا پوٹیشیم نائٹریٹ کو جب سلفیورک ایسڈ کے ساتھ ملا کر گرم کیا جاتا ہے تو نائٹرک ایسڈ بنتا ہے۔
صنعتی پیمانے پر نائٹرک ایسڈ اوسوالڈ کے طریقے سے حاصل کیا جاتا ہے۔
مرتکز نائٹرک ایسڈ
اگر نائٹرک ایسڈ میں پانی کی مقدار نہ ہونے کے برابر ہو تو اسے مُرتکز نائٹرک ایسڈ کہتے ہیں۔مرتکز نائٹرک ایسڈ کو فیومنگ نائٹرک ایسڈ بھی کہتے ہیں کیونکہ اگر اس پر پھونک ماری جائےتو اس پر سے دھواں (fumes) سا اٹھتا ہوا دکھائی دیتا ہے۔
اگر نائٹرک ایسڈ میں پانی کی مقدار بہت زیادہ ہو تو گرم کرنے سے پانی کی مقدار کم ہونے لگتی ہے اور نائٹرک ایسڈ کسی حد تک مرتکز بن جاتا ہے مگر اس طرح 68 فیصد سے زیادہ مرتکز نائٹرک ایسڈ حاصل نہیں کیا جا سکتا کیونکہ نائٹرک ایسڈ پانی کے ساتھ ایزیوٹروپ بنا لیتا ہے۔
اگر 68 فیصد سے زیادہ مرتکز نائٹرک ایسڈ کو گرم کیا جائےتواس میں نائٹرک ایسڈ کی مقدار کم ہونے لگتی ہے اور 68 فیصد پر آ کر ٹھہر جاتی ہے۔ سارے ہی ایزیوٹروپ مکسچر ایسا ہی برتاو رکھتے ہیں۔
بسمتھ کے نمکیات مرتکز نائٹرک ایسڈ میں حل ہو جاتے ہیں مگر پانی ملے نائٹرک ایسڈ میں حل نہیں ہوتے۔
تانبا مرتکز نائٹرک ایسڈ کے ساتھ عمل نہیں کرتا کیونکہ اس تیزاب کی وجہ سے تابنے پر passivation layer بن جاتی ہے۔ لیکن جب اس میں تھوڑا سا پانی ملایا جاتا ہے تو تیز عمل شروع ہو جاتا ہے اور بھورے رنگ کی گیس خارج ہوتی ہے۔یہ نائٹروجن ڈائی آکسائیڈ ہوتی ہے اور زہریلی ہوتی ہے۔
نائٹریٹنگ آمیزہ
سلفیورک ایسڈ اور نایٹرک ایسڈ کا جو آمیزہ ہوتا ہے اس میں یہ صلاحیت ہوتی ہے کہ یہ لگ بھگ کسی بھی مادے میں نائٹریٹ گروپ داخل کر دیتا ہے۔ اس لیے اس کو نایٹریٹنگ آمیزہ یا مکسچر کہتے ہے۔ مثلاً سیلولوز کو یہ سیلولوز نائٹریٹ بنادیتا ہے اور گلیسرول کو گلیسیرول نایٹریٹ بناتا ہے۔ اسی طرح [4]ہیکزاماین کو ہیکزامین نائٹریٹ بناتا ہے۔
احتیاط
نائٹرک ایسڈ کو شیشے کی بوتل میں رکھنا چاہیے کیونکہ اکثر پلاسٹک نائٹرک ایسڈ کی وجہ سے کچھ وقت کے بعد پاپڑ کی طرح نازک ہو جاتے ہیں اور پلاسٹک کی بوتلوں سے یہ تیزاب بہہ نکلتا ہے۔
مزید دیکھیے
حوالہ جات
- "NIOSH Pocket Guide to Chemical Hazards #0447"۔ National Institute for Occupational Safety and Health (NIOSH)۔
- R. P. Bell، The Proton in Chemistry (اشاعت 2nd۔)، Ithaca, NY: Cornell University Press
- Zumdahl, Steven S.۔ Chemical Principles 6th Ed.۔ Houghton Mifflin Company۔ صفحہ A22۔ آئی ایس بی این 0-618-94690-X۔
- Make Nitric Acid - the Complete Guide