கந்தக டிரையாக்சைடு
கந்தக டிரையாக்சைடு (Sulfur trioxide) என்பது SO3 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். கந்தக மூவாக்சைடு, சல்பர் டிரையாக்சைடு என்ற பெயர்களாலும் இதை அழைக்கலாம். ஒப்பீட்டளவில் இது எளிதில் திரவமாகும் வரம்பைக் கொண்டுள்ளது. வாயு வடிவ கந்தக டிரையாக்சைடு ஒரு குறிப்பிடத்தக்க மாசுபடுத்தியாகும். அமில மழையின் முதன்மை முகவராக இது உள்ளது.
| |||
| பெயர்கள் | |||
|---|---|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
கந்தக டிரையாக்சைடு | |||
| முறையான ஐயூபிஏசி பெயர்
சல்போனிலிடின் ஆக்சிடேன் | |||
| வேறு பெயர்கள்
கந்தக நீரிலி, கந்தக(VI) ஆக்சைடு | |||
| இனங்காட்டிகள் | |||
| 7446-11-9 | |||
| ChEBI | CHEBI:29384 | ||
| ChemSpider | 23080 | ||
| EC number | 231-197-3 | ||
Gmelin Reference |
1448 | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 24682 22235242 (பாதி நீரேற்று) 23035042 (ஒரு நீரேற்று) | ||
| வே.ந.வி.ப எண் | WT4830000 | ||
SMILES
| |||
| UNII | HH2O7V4LYD | ||
| UN number | UN 1829 | ||
| பண்புகள் | |||
| SO3 | |||
| வாய்ப்பாட்டு எடை | 80.066 கி/மோல் | ||
| தோற்றம் | நிறமற்றது முதல் வெண்மை நிற ஒஅடிகத் திண்மம். காற்றில் புகையும்.[1] நிறமற்ற நீர்மம் மற்றும் வாயு.[2] | ||
| மணம் | மாறுபடும். கந்தக டை ஆக்சைடு போல ஆவி காரச்சுவை கொண்டது.[3] மூட்டம் நெடியற்றது.[2] | ||
| அடர்த்தி | 1.92 g/cm3, நீர்மம் | ||
| உருகுநிலை | |||
| கொதிநிலை | 45 °C (113 °F; 318 K) | ||
| கந்தக அமிலம் உருவாகும் | |||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
−395.7 கிலோயூல்/மோல் | ||
| நியம மோலார் எந்திரோப்பி S |
256.77 J K−1 mol−1 | ||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | |||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 1202 | ||
| GHS pictograms |   | ||
| GHS signal word | அபாயம் | ||
| H250, H314, H310, H300, H335 | |||
| P261, P270, P280, P305+351+338, P310 | |||
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றாது | ||
| Lethal dose or concentration (LD, LC): | |||
LC50 (Median concentration) |
rat, 4 hr 375 mg/m3 | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய நேர் மின்அயனிகள் | செலீனியம் டிரையாக்சைடு தெலூரியம் மூவாக்சைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
கந்தக அமிலம் தயாரிக்க உதவும் முன்னோடிச் சேர்மமாக கருதப்பட்டு தொழில்துறை அளவில் கந்தக டிரையாக்சைடு தயாரிக்கப்படுகிறது.
முற்றிலும் உலர்ந்த கொள்கலன்களில் கந்தக டிரையாக்சைடு ஆவி கண்களுக்குத் தெரியாது. திரவ நிலையில் இது வெளிப்படையாக ஒளிபுகும் தன்மையையுடன் உள்ளது. இருப்பினும் கந்தக அமில மூடுபனி போல உருவாவதால் ஒப்பீட்டளவில் வறண்ட வளிமண்டலத்தில் கூட அதிகமாக புகைகிறது. எனவே இது ஒரு புகை முகவராகவும் பயன்படுத்தப்படுகிறது. நெடியற்ற சேர்மமாக காணப்படும் கந்தக டிரையாக்சைடு அதிகமான அரிக்கும் பண்பைக் கொண்டுள்ளது[2]
மூலக்கூற்று கட்டமைப்பும் பிணைப்பும்
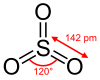
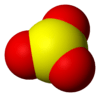
D3h சீரொழுங்குடன் முக்கோணத் தள மூலக்கூற்று வடிவமும் இடக்குழுவும் கொண்டு வாயு நிலை கந்தக டிரையாக்சைடு காணப்படுகிறது. வலுவளவு ஓட்டு இலத்திரன் சோடிகளின் தள்ளுகைக் கொள்கை இதை முன்கணித்துக் கூறுகிறது
எலக்ட்ரான்-எண்ணும் சம்பிரதாய முறையைப் பொறுத்தவரை, கந்தக அணு +6 என்ற ஆக்சிசனேற்ற நிலையிலும் முறையான 0 என்ற மின்சுமை மதிப்பும் கொண்டிருக்கிறது. லூயிசு கட்டமைப்பில் டி-ஆர்பிட்டால்களைப் பயன்படுத்தாமல் S=O (இரட்டை பிணைப்பு) S–O (ஈதற்பிணைப்பு) ஆகியன உள்ளன[4].
வாயுநிலை கந்தக டிரையாக்சைடின் மின் இருமுனை திருப்புத் திறன் சுழியாகும். இது S-O பிணைப்புகளுக்கு இடையிலான 120 ° கோணத்தின் விளைவாகும்.
திண்ம கந்தக டிரையாக்சைடின் கட்டமைப்பு
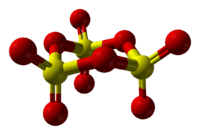
திண்ம கந்தக டிரையாக்சைடின் இயற்கை தன்மை சிக்கலானது, ஏனெனில் கட்டமைப்பு மாற்றங்கள் நீரின் தடயங்களால் ஏற்படுகின்றன[5].
இவ்வாயுவை ஒடுக்கும்போது முற்றிலும் தூய்மையான SO3 வாயு ஒரு முப்படியாக ஒடுக்கப்படுகிறது. இது பெரும்பாலும் γ-SO3 என அழைக்கப்படுகிறது. இந்த மூலக்கூற்று வடிவம் 16.8. செல்சியசு உருகுநிலையுடன் நிறமற்ற திண்மமாக உள்ளது. இது [S (= O) 2 (μ-O)] என விவரிக்கப்படும் ஒரு வளைய சி கட்டமைப்பை ஏற்றுக்கொள்கிறது[6].
SO3 வாயு 27 ° செல்சியசுக்கு மேல் ஒடுக்கப்பட்டால், α-SO3 வடிவம் தோன்றுகிறது. இது 62.3. செல்சியசு உருகுநிலையைக் கொண்டுள்ளது. ஆல்பா-SO3 தோற்றத்தில் இழை போல காணப்படுகிறது. கட்டமைப்பு ரீதியாக, இது பாலிமர் [S (= O) 2 (μ-O)] n ஆகும். பாலிமரின் ஒவ்வொரு முனையும் OH குழுக்களுடன் நிறுத்தப்படுகின்றன.
β-SO3, ஆல்பா வடிவத்தைப் போலவே, இழை போன்றதாகும். ஆனால் வெவ்வேறு மூலக்கூறு எடையைக் கொண்டு ஐதராக்சில் குழு மூடிய பலபடியைக் கொண்டுள்ளது, 32.5 பாகை செல்சியசு வெப்பநிலையில் இது உருகும். காமா மற்றும் பீட்டா கந்தக டிரையாக்சைடு வடிவங்கள் இரண்டும் சிற்றுருதி கொண்டவை ஆகும். போதுமான நேரம் நின்றால் இவை நிலையான ஆல்பா வடிவமாக மாறுகின்றன. இந்த மாற்றம் நீரின் தடயங்களால் ஏற்படுகிறது[7].
திண்ம SO3 இன் ஒப்பீட்டு நீராவி அழுத்தங்கள் ஒரே மாதிரியான வெப்பநிலையில் ஆல்பா <பீட்டா <காமா என அமைகிறது. அவை அவற்றின் தொடர்புடைய மூலக்கூறு எடைகளைக் குறிக்கின்றன. நீர்ம கந்தக டிரையாக்சைடு காமா வடிவத்துடன் ஒத்த நீராவி அழுத்தத்தைக் கொண்டுள்ளது. இதனால் ஆல்பா-SO3 வடிவப் படிகத்தை அதன் உருகுநிலைக்கு வெப்பமாக்கும்போது நீராவி அழுத்தம் திடீரென அதிகரிக்கிறது. இந்த அதிகரிப்பு சூபடுத்தப் பயன்படுத்தும் கண்ணாடி பாத்திரத்தை சிதறடிக்கும் அளவுக்கு வலிமையாக இருக்கும். இந்த விளைவை ஆல்பா வெடிப்பு என்று அழைக்கின்றனர்[7].
SO3 ஒரு தீவிரமான நீருறிஞ்சியாகும். கந்தக டிரையாக்சைடு உடன் மரம் அல்லது பருத்தியின் கலவையை பற்றவைக்கக்கூடிய அளவு நீரேற்ற வெப்பம் போதுமானதாகும். . இதுபோன்ற சந்தர்ப்பங்களில், SO3 இந்த கார்போவைதரேட்டுகளை நீரிழக்கச் செய்கிறது[7].
வேதி வினைகள்
SO3 வாயு கந்தக அமிலத்தினுடைய (H2SO4) நீரிலியாகும். எனவே பின்வரும் வினைகள் நிகழ்கின்றன.
- SO3 (g) + H2O (l) → H2SO4 (aq) (ΔHf = −200 கிலோயூல் மோல்−1]])[8] இவ்வினை தீவிரமாகவும் வெப்ப உமிழ்வினையாகவும் நிகழ்கிறது.
கந்தக டைகுளோரைடை பயனுள்ள ஒரு வினையூக்கியான தயோனைல் குளோரைடாக கந்தக டிரையாக்சைடு ஆக்சிசனேற்றுகிறது
- SO3 + SCl2 → SOCl2 + SO2
SO3 வாயு ஒரு வலிமையான லூயிசு அமிலமாகும். பிரிடின், டையாக்சேன், டிரைமெத்திலமீன் ஆகியவற்றுடன் சேர்ந்து படிக அணைவுச் சேர்மங்களை இது உருவாக்குகிறது. இவை சல்போனேற்றும் முகவர்களாகச் செயல்படுகின்றன[9].
தயாரிப்பு
ஆய்வகத்தில் கந்தக டிரையாக்சைடை சோடியம் பைசல்பேட்டை வெப்பச் சிதைவு வினைக்கு உட்படுத்தி இரண்டு படிநிலைகளில் தயாரிக்கலாம். சோடியம் பைரோசல்பேட்டு ஓர் இடைநிலை விளைபொருளாக உருவாகிறது:[10]
- 315° செல்சியசில் நிர்நீக்கம்:
- 2 NaHSO4 → Na2S2O7 + H2O
- 460°செல்சியசில் பிளவு:
- Na2S2O7 → Na2SO4 + SO3
மாறாக, KHSO4 இதுபோன்ற வினைக்கு உட்படுவதில்லை[10].
தொழில்துறை ரீதியாக SO3 தொடுகைச் செயல்முறையில் உருவாக்கப்படுகிறது. கந்தகம் அல்லது இரும்பினுடைய சல்பைடு தாதுவான இரும்பு பைரைட்டை எரிப்பதன் மூலமும் கந்தக டிரையாக்சைடு உற்பத்தி செய்யப்படுகிறது. மின்காந்த வீழ்படிவாக்கல் முறையில் சுத்திகரிக்கப்பட்ட பின்னர் கந்தக டையாக்சைடு வளிமண்டல ஆக்சினால் 400 முதல் 600 ° செல்சியசு வெப்பநிலையில் ஒரு வினையூக்கியின் உதவியால் ஆக்சிசனேற்றப்படுகிறது. குறிப்பாக சிலிக்கா அல்லது கிய்செல்கர் வகை படிவுப்பாறை மீது செயலூக்கப்பட்ட பொட்டாசியம் ஆக்சைடும் வனேடியம் பெண்டாக்சைடும் இக்குறிப்பிட்ட வினையூக்கியில் உள்ளன. பிளாட்டினமும் ஒரு நல்ல வினையூக்கியாகும் என்றாலும் அது மிகவும் விலை உயர்ந்தது மற்றும் அசுத்தங்களால் மிகவும் எளிதில் பாதிக்கப்படக்கூடியது ஆகும்.
ஒரு காலத்தில் கால்சியம் சல்பேட்டுடன் சிலிக்காவைச் சேர்த்து சூடுபடுத்தி தொழில்முறையில் இதைத் தயாரித்தார்கள்.
பயன்பாடுகள்
கந்தக டிரையாக்சைடு சல்போனேற்ற வினைக்கு உதவும் ஒரு முக்கியமான வினைக்காரணியாகும். இந்த செயல்முறைகள் சவர்க்காரம், சாயங்கள் மற்றும் மருந்துகள் தயாரிப்பில் உதவுகின்றன. கந்தக அமிலத்திலிருந்து தளத்திலேயே கந்தக டிரையாக்சைடு உருவாக்கப்படுகிறது அல்லது அமிலத்தில் ஒரு கரைசலாகப் பயன்படுத்தப்படுகிறது.
முன்பாதுகாப்பு
ஒரு வலுவான ஆக்சிசனேற்ற முகவராக இருப்பதோடு கந்தக டிரையாக்சைடு உட்செலுத்துதல் மற்றும் உட்கொள்ளல் ஆகிய இரண்டு செயல்களிலும் கடுமையான புண்களை ஏற்படுத்தும், ஏனெனில் இது இயற்கையில் மிகவும் அரிக்கும் மற்றும் நீருறிஞ்சும் பண்புகளைப் பெற்றுள்ளது. தண்ணீருடன் கந்தக டிரையாக்சைடு தீவிரமாக வினைபுரிந்து கந்தக அமிலம் உருவாகும் என்பதால் தீவிர கவனத்துடன் இது கையாளப்பட வேண்டும். வலுவான நீர்நீக்கும் தன்மை காரணமாகவும் அத்தகைய பொருட்களுடன் தீவிரமாக வினைபுரியும் என்பதாலும் இதை கரிம பொருட்களுடன் கலக்காமல் விலக்கி வைத்திருத்தல் அவசியமாகும்.
இதையும் காண்க
மேற்கோள்கள்
- "SULFUR TRIOXIDE CAMEO Chemicals NOAA".
- Lerner, L. (2011). "Small-Scale Synthesis of Laboratory Reagents with Reaction Modeling". CRC Press.
- "Substance:Sulfur trioxide - Learn Chemistry Wiki".
- Terence P. Cunningham , David L. Cooper , Joseph Gerratt, Peter B. Karadakov and Mario Raimondi (1997). "Chemical bonding in oxofluorides of hypercoordinate sulfur". Journal of the Chemical Society, Faraday Transactions 93 (13): 2247–2254. doi:10.1039/A700708F.
- Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth–Heinemann. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- Merck Index of Chemicals and Drugs, 9th ed. monograph 8775
- "The Manufacture of Sulfuric Acid and Superphosphate". Chemical Processes in New Zealand.
- வார்ப்புரு:Cotton&Wilkinson6th
- K.J. de Vries; P.J. Gellings (May 1969). "The thermal decomposition of potassium and sodium-pyrosulfate". Journal of Inorganic and Nuclear Chemistry 31 (5): 1307–1313. doi:10.1016/0022-1902(69)80241-1. https://research.utwente.nl/en/publications/the-thermal-decomposition-of-potassium-and-sodium-pyrosulfate.