குரோமியம்(VI) ஆக்சைடு பெராக்சைடு
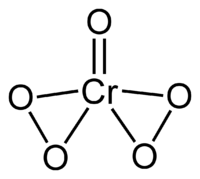
குரோமியம்(Chromium(VI) peroxide) என்பது CrO5 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட நிலைப்புத்தன்மையற்ற ஒரு கனிம வேதியியல் வேதிச் சேர்மம் ஆகும். குரோமியம்(VI) பெராக்சைடு குரோமியம் ஆக்சைடு பெராக்சைடு என்ற பெயராலும் இச்சேர்மம் அழைக்கப்படுகிறது. அமிலமாக்கப்பட்ட ஐதரசன் பெராக்சைடு கரைசலை சோடியம் குரோமேட்டு போன்ற உலோகக் குரோமேட்டுகளுடன் சேர்த்து வினைபுரியச் செய்யும் போது குரோமியம்(VI) பெராக்சைடு உருவாகிறது. பொதுவான மஞ்சள் நிற குரோமேட்டுகள் அடர் நீலப்-பழுப்பு குரோமியம்(VI) பெராக்சைட்டாக மாற்றமடைகிறது. இவ்வுலோகக் குரோமேட்டு ஓர் அமிலம் மற்றும் ஐதரசன் பெராக்சைடுடன் வினைபுரிந்து குரோமியம் பெராக்சைடு, தண்ணீர் மற்றும் அவ்வமிலத்தினுடைய உலோக உப்பு ஆகியனவற்றைக் கொடுக்கிறது.
- M2CrO4 + 2 H2O2 + 2 H+ → CrO5 + 3 H2O + 2 M+
 | |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
குரோமியம்(VI) ஆக்சைடு பெராக்சைடு, குரோமியம் பெண்டாக்சைடு | |
| இனங்காட்டிகள் | |
| 35262-77-2 | |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
SMILES
| |
| பண்புகள் | |
| CrO5 | |
| வாய்ப்பாட்டு எடை | 131.99 g·mol−1 |
| கரைகிறது (நிலைப்படுத்திகள் இல்லாமல் சிதைகிறது.) | |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
சில நிமிடங்களுக்குப் பின்னர், குரோமியம்(VI) பெராக்சைடு சிதைவடைந்து பச்சை நிறமுள்ள குரோமியம்(III) சேர்மங்களைக் கொடுக்கிறது [1]. டை எத்தில் ஈதர், பியூட்டேன்-1-ஆல் அல்லது அமைல் அசிட்டேட்டு போன்ற நீருடன் கலவா கரிமக் கரைப்பான்களை, குரோமியம்(VI) பெராக்சைடைடுடன் ஐதரசன் பெராக்சைடு சேர்க்கும் போது சேர்த்து கலக்குவதன் மூலம் இச்சேர்மம் சிதைவடைதலை தடுக்க முடியும். நிலைப்புத்தன்மையற்ற குரோமியம்(VI) பெராக்சைடானது இவ்வழிமுறையில் நீருடன் கலவா கரிமக்கரைபானுடன் கரைக்கப்படுகிறது. இந்நிபந்தனையுடன் தயாரிக்கப்பட்டால் நீண்ட நாட்களுக்கு நிலைத்து இருக்கிறது.
- 2 CrO5 + 7 H2O2 + 6 H+ → 2 Cr3+ + 10 H2O + 7 O2
ஓர் ஆக்சோ ஈந்தணைவியும் இரண்டு பெராக்சோ ஈந்தணைவிகளும் இணைந்து ஒட்டு மொத்தமாக ஒரு குரோமியம் அணுவுக்கு ஐந்து ஆக்சிசன் அணுக்கள் என்ற விகிதத்தை உண்டாக்குகிறது.
வழிப்பொருட்கள்
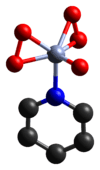
கரிம வேதியியலில் ஈதரேட்டு என்பது முக்கியமான ஒரு அணைவுச் சேர்மம் ஆகும். ஒரு சேர்மத்துடன் ஈதர் சேர்ந்து உருவாகும் அணைவுச் சேர்மங்கள் ஈதரேட்டுகள் எனப்படுகின்றன. இச்சேர்மத்தின் பிரிடைல் மற்றும் பைபிரிடைல் அணைவுச் சேர்மங்கள் திறன்மிகுந்த ஆக்சிசனேற்றிகளாகக் கருதப்படுகின்றன [2]. பிரிடைல் அணைவுச் சேர்மங்களின் கட்டமைப்பு படிகவியல் முறையில் உறுதிப்படுத்தப்படுகிறது [3].
மேற்கோள்கள்
- Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils; (1985). "Chromium" (in German). Lehrbuch der Anorganischen Chemie (91–100 ed.). Walter de Gruyter. pp. 1081–1095. ISBN 3-11-007511-3."
- Firouzabadi, H.; Iranpoor, N.; Kiaeezadeh, F.; Toofan, J. (1986). "Chromium(VI) based oxidants-1 Chromium peroxide complexes as versatile, mild, and efficient oxidants in organic synthesis". Tetrahedron 42: 719. doi:10.1016/S0040-4020(01)87476-7.
- Stomberg, Rolf (1962). "Crystal Structure of Peroxochromates, CrO5⋅C5H5N". Nature 196 (4854): 570. doi:10.1038/196570b0.
படக்காட்சியகம்
 குரோமியம் பெராக்சைடின் நீர்த்தக் கரைசல்
குரோமியம் பெராக்சைடின் நீர்த்தக் கரைசல் குரோமியம் பெராக்சைடின் மிக நீர்த்தக் கரைசல்
குரோமியம் பெராக்சைடின் மிக நீர்த்தக் கரைசல்_oxide_peroxide_(stabilized_in_ether_phase).jpg) ஈதர் முன்னிலையில் நிலைப்படுத்தப்பட்ட குரோமியம்(VI) பெராக்சைடு (மேலே) மற்றும் குரோமியம்(III) நீர்க்கரைசல் (கீழே).
ஈதர் முன்னிலையில் நிலைப்படுத்தப்பட்ட குரோமியம்(VI) பெராக்சைடு (மேலே) மற்றும் குரோமியம்(III) நீர்க்கரைசல் (கீழே).
புற இணைப்புகள்
- Experimental details and photo (செருமன் மொழி)